خوردگی گالوانیک محتویات مقدمه فرایند کلی نمونههایی از خوردگی سری گالوانیک منابع منوی ناوبریگسترش آن
خوردگی
انگلیسیخوردگیپتانسیل الکتریکیپیل الکتروشیمیاییحفاظت کاتدیسری گالوانیکمجسمه آزادیگوستاو ایفلانگلیسیانگلیسیلاک ناخنپلی تترافلوئورواتیلنایالات متحده آمریکابریتانیاساموئل پپیسانگلیسیکرم کشتیانگلیسیانگلیسیلازانیا
خوردگی گالوانیک
پرش به ناوبری
پرش به جستجو
خوردگی گالوانیک (به انگلیسی: Galvanic corrosion) به خوردگی در اثر وجود اختلاف پتانسیل الکتریکی بین فلزات در ارتباط با یکدیگر گفته میشود. اختلاف پتانسیل باعث شارش الکترونها بین این دو فلز میشود. در این حالت فلز دارای پتانسیل تعادلی کمتر، آند پیل الکتروشیمیایی را تشکیل داده و خورده میشود. فلز کاتد خورده نمیشود یا خوردگی آن بسیار کم میشود. در اتصال دو فلز غیر همجنس تشدید خوردگی آند را خوردگی گالوانیکی و کاهش خوردگی کاتد را حفاظت کاتدی گویند.
به منظور کاهش یا به حد اقل رساندن میزان خوردگی گالوانیکی از روشهای تجربی گوناگون استفاده میشود. روشهای معمول در این موارد به قرار زیر هستند:
الف) انتخاب فلزاتی که تا حد امکان در جدول سری گالوانیک به هم نزدیکتر باشند.
ب) اجتناب از تأثیر نامطلوب مساحتها (آند کوچک و کاتد بسیار بزرگ).
ج) عایق کردن فلزات غیر همجنس تا حدی که امکان اجرای عملی آن وجود داشته باشد.
د) انجام پوشش مناسب مخصوصاً در منطقهٔ آندی
ه) استفاده از بازدارندهها جهت کاهش خورندگی محیط
و) اجتناب از اتصالات پیچی در مورد فلزاتی که در سری گالوانیکی از همدیگر خیلی دور باشند
ز) طراحی قطعات طوری صورت گیرد که قسمت آندی را بتوان به راحتی تعویض نمود یا این قسمتها به منظور دوام و عمر بیشتر، ضخیمتر ساخته شوند
ح) تعبیه یک فلز ثالث در تماس با آنها به طوری که نسبت به هر دو فلز قبلی، دارای پتانسیل الکتریکی بالاتری باشد (خاصیت آندی بیشتر)
محتویات
۱ مقدمه
۲ فرایند کلی
۳ نمونههایی از خوردگی
۳.۱ مجسمهٔ آزادی
۳.۲ نیروی دریایی سلطنتی و کشتی اچ ام اس آلارم
۳.۳ سلول لازانیا
۴ سری گالوانیک
۵ منابع
مقدمه
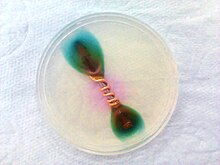
تصویری از خوردگی میخ آهنی که با سیم مسی پوشانده شده است، این تصویر حفاظت کاتدی مس را نشان میدهد
خوردگی گالوانیک (یا خوردگی دو فلزی) یک فرایند الکتروشیمیایی است که در آن یک فلز در حالی که در حضور یک الکترولیت در تماس با یک فلز دیگر میباشد دچار خوردگی میشود. نمونهٔ مشابه واکنشهای گالوانیک در پیلهای شیمیایی (همان باطریهای معمولی) برای ایجاد ولتاژ الکتریکی مناسب برای تأمین انرژی وسایل الکتریکی قابل حمل وجود دارد.[۱]
فرایند کلی
فلزات و آلیاژهای مختلف مواد دارای پتانسیلهای الکترودی متفاوتی هستند، و زمانی که دو یا چند فلز یا آلیاژ مختلف در یک الکترولیت در تماس با یکدیگر قرار میگیرند، یک فلز نقش آند و دیگری نقش کاتد را ایفا خواهند کرد. اگر الکترولیت تنها شامل یونهای فلزی باشد که به راحتی کاهش شیمیایی نمییابند (مانند یون یک بار مثبت سدیم و پتاسیم یا یون دو بار مثبت کلسیم، منیزیم و روی)، فرایند کاتد شامل کاهش یون هیدروژن مثبت از مولکول هیدروژن یا اکسیژن برای تشکیل یون منفی هیدروکسید خواهد بود.[۲] تفاوت پتانسیل الکتریکی میان میان واکنشهایی که در دو الکترود انجام میشود، محرک حملهٔ شتابدار به قسمت فلز آند سیستم میشود که به کاهش آن در الکترولیت میانجامد. این فرایند باعث این میشود که در فلز آند خوردگی سریع تر انجام شود و از خوردگی فلز کاتد جلوگیری شود. وجود یک الکترولیت و در واقع وجود یک مسیر عبوردهندهٔ الکتریکی بین فلزات برای وقوع خوردگی گالوانیک ضروری میباشد. الکترولیت امکانی را برای حرکت یونها فراهم میآورد که این موضوع برای انباشته نشدن بار الکتریکی در قسمتهای آند و کاتد سیستم و در نتیجه انجام فرایند شیمیایی خوردگی گالوانیک لازم میباشد.[۳]
در بعضی موارد، این فرایند به شدت مطلوب تلقی میشود. برای مثال در باطریهای ارزان قیمتی که مصارف خانگی دارند به طور معمول دارای سلولهای کربن-روی هستند، به عنوان قسمتی از یک مدار بستهٔ الکتریکی (در مسیر حرکت الکترونها)، فلز روی داخل سلول دچار خوردگی میشود (مسیر یون) که این فرایند یک قسمت ضروری برای تولید الکتریسیته در باطری میباشد. به عنوان مثال دیگر میتوان حفاظت کاتدی ساختارهای غوطه ور و یا دفن شده را نام برد. مانند تانکهای ذخیرهٔ آب داغ. در این مورد، آندها به عنوان قسمتی از جفت گالوانی کار میکنند که باعث خوردگی فلز قسمت آند و در عوض حفاظت فلز قسمت کاتد میشود. در موارد دیگر، مانند فلزهای مخلوط در لوله سازی (برای مثال مس، آهن ریختهگری و فلزات ریختهگری دیگر)، خوردگی گالوانیک در خوردگیهای شتاب یافتهٔ قسمتهای مختلف سیستم شرکت میکند و به عبارت دیگر خوردگی در بسیاری از قسمتهای سیستم ناشی از این نوع خوردگی (خوردگی گالوانیک) میباشد.
مواد مانع شوندهٔ خوردگی مانند سدیم نیتریت یا سدیم مولیبدیت میتوانند در این سیستمها تزریق شوند تا پتانسیل گالوانی را کاهش دهند، اگرچه عمل اضافه کردن این مواد ضد خوردگی باید به طور دقیق تحت نظر قرار گیرد، به طوری که اگر عمل اضافه کردن مواد ضد خوردگی منجر به افزایش رسانایی الکتریکی آب داخل سیستم شود، پتانسیل خوردگی گالوانیک ممکن است افزایش چشمگیری داشته باشد.
اسیدی یا بازی بودن (با نماد اختصاری PH) نیز یک عامل مهم در سیستمهای گردشی بستهٔ دو فلزی میباشد. به طوری که اگر مقدار اسیدی یا بازی بودن با مقدار مادهٔ ضد خوردگی تناسب نداشته باشد، خوردگی گالوانیک با سرعت بیشتری انجام میشود. در اغلب سیستمهای گرمایشی و سرمایشی خانگی، استفاده از آندهای فداشونده و کاتدها، دیگر مطلوب نمیباشد، چرا که آنها باید داخل لوله کشی ساختمانها نصب شوند و بعد از گذشت زمان، دچار خوردگی و زنگ زدگی میشود و باعث آزاد شدن ذراتی داخل لولهها شده و این امر میتواند موجب آسیبهای پتانسیلی و مکانیکی در پمپهای گردشی، مبدلهای حرارتی و… شود.
نمونههایی از خوردگی
نمونهٔ رایج خوردگی گالوانیک درآهنهای کرکره (یک ورق استیل که با فلز روی پوشانده شده است) رخ میدهد، حتی زمانی که پوشش محافظت کنندهٔ روی شکسته میشود، لایهٔ استیل زیرین سالم باقی میماند. در عوض، روی دچار خوردگی میشود چرا که استیل نسبت به آن نجیب تر است. تنها در صورتی که روی به طور کامل دچار زنگ زدگی یا خوردگی شود، فلز پایه ای به تدریج دچار خوردگی خواهد شد. در مقابل، در قوطیهای قدیمی از جنس قلع (قوطیهای حلبی)، عکس عملیات قبلی اتفاق میافتد، چرا که قلع از استیل موجود در لایهٔ زیرین نجیب تر میباشد، هرگاه این پوشش قلع شکسته شود، لایهٔ استیل زیرین به تدریج شروع به فرایند خوردگی میکند.
مجسمهٔ آزادی

خوردگی گالوانیک در مجسمه آزادی

بازرسیهای نظارتی نشان داد که مجسمه آزادی دچار خوردگی گالوانیک شده بود
یک نمونهٔ عالی از خوردگی گاوانیک در مجسمه آزادی اتفاق افتاده است، به طوری که بررسیهای مربوط به نگهداری از این اثر در دهه ۱۹۸۰ نشان میدهد که خوردگی بین لایهٔ بیرونی مس و چارچوب اصلی مجسمه که از جنس آهن بوده است اتفاق افتاده است. اگرچه این موضوع زمانی که گوستاو ایفل (به انگلیسی: Gustave Eiffel) این سازه را بر اساس طرحی از فردریک بارتولدی (به انگلیسی: Frederic Barthldy) ساخت، پیشبینی شده بود و لایه ای عایق از جنس نوعی رزین مانند لاک ناخن روی چارچوب آهنی مجسمه تعبیه شده بود اما با گذشت زمان این لایه در عایق نگه داشتن بدنهٔ آهنی دچار مشکل شده و سبب زنگ زدن تدریجی پایههای آهنی این سازه شده بود. در یک عملیات تعمیر گسترده که در طی آن همهٔ قسمتهای مجسمه مجزا شدند، یک لایهٔ عایق از جنس پلی تترافلوئورواتیلن (با نماد اختصاری PTFE) جایگزین لایهٔ عایق قبلی شد. ساختار سازه به خاطر بسیاری از اتصالات که آسیب ندیده بودند از حالت غیر ایمن فاصلهٔ زیادی داشت، اما این کار، عملی پیشگیرانه برای حفاظت از سازه ای که نمادی از کشور ایالات متحده آمریکا میباشد، محسوب میشود.[۴][۵]
نیروی دریایی سلطنتی و کشتی اچ ام اس آلارم
در قرن هفدهم در بریتانیا، ساموئل پپیس (به انگلیسی: Samuel Pepys) در کسوت مشاورهٔ ادارهٔ نیروی دریایی انگلستان، با جدا کردن پوشش سربی از کشتیهای نیروی دریایی سلطنتی انگلستان جهت جلوگیری از شکستنهای غیرعادی در سکانهای آهنی و پیجهای به کار رفته در کشتیها موافقت کرد. او همچنین اعتراف کرد که خود او باعث به کارگیری سرب و در نتیجهٔ آن خوردگی سرب در تجهیزات مربوط به کشتی شده است.[۶] این مشکل به طور مشابه برای کشتیهایی که پوشش مسی برای حمل بارهای علف و جلوگیری از نفوذ کرم کشتی (به انگلیسی: Shipworm) داشتند، اتفاق افتاد.
در آزمایشی در سال ۱۷۶۱، نیروی دریایی سلطنتی استفاده از صفحات ۱۲ اونسی مس را برای تمام بدنهٔ اصلی کشتی اچ ام اس آلارم (به انگلیسی: HMS Alarm) امتحان کرد، در بازگشت این کشتی از سفری از شرق هند، با وجود این که صفحات مسی شرایط مطلوبی داشتند و از نفوذ کرمهای کشتی جلوگیری کرده بودند، صفحهٔ کفی بدنهٔ کشتی که از جنس چوب بودند در بسیاری از نقاط از صفحات مسی جدا شده بودند که این اتفاق به علت استفاده از میخهای آهنی در پروسهٔ ساخت این این کشتی بود. در واقع این میخها به صورت نوعی خمیر زنگ زده درآمده بودند.[۷] البته برخی از این میخهای آهنی ظاهراً آسیب ندیده بودند که این موضوع تعجب گروههای بازرسی را برانگیخته بود. بررسی دقیق تر نشان داد که کاغذهای قهوه ای ضد آبی که به صورت غیرعمدی زیر قسمت هد بعضی از این میخها قرار گرفته بودند، از آنها محافظت کرده بودند. به طوری که هر جا که این کاغذها به صورت محافظ کامل قرار داشتند، آهن از آسیب دیدن محافظت شده بود. این کاغذها در واقع در کارخانه یسازندهٔ این صفحات مسی برای کشتی سازی روی این صفحات کشیده شده بود که گاهی این پوششها را از صفحات مسی جدا نمیکردند و به همان صورت در بدنهٔ کشتی آنها را با پیچ متصل میکردند. در نهایت نتیجهٔ این موضوع که آهن نباید در تماس مستقیم با صفحات مسی -که در بدنهٔ کشتیهایی که در آب دریا حرکت میکنند- باشد، به ادارهٔ نیروی دریایی گزارش شد.[۸]
سلول لازانیا
یک سلول لازانیا به صورت اتفاقی زمانی تشکیل شد که یک غذای خمیری نمک دار مانند لازانیا در یک تابهٔ از جنس استیل با پوشش رویی از جنس فویل آلومینیوم نگهداری شد. بعد از چند ساعت، در فویل سوراخهای ریزی در قسمتی که با لازانیا در برخورد بود پدید آمد و در سطح غذا نقاط ریزی دیده شد که که از جنس آلومینیوم خورده شده بود.[۹] در این نمونه، غذای نمک دار (لازانیا) نقش الکترولیت، فویل آلومینیومی نقش آند، و تابهٔ استیل نقش کاتد را ایفا کردند. در صورتی که فویل آلومینیوم در قسمتهای کوچکی با غذا در تماس باشد، خوردگی گالوانیک متمرکز میشود و عمل خوردگی ممکن است با سرعت قابل توجهی انجام شود. اگر در عوض از یک تابهٔ آلومینیومی استفاده شود، سرعت خوردگی به شدت کاهش مییابد ولی همچنان ممکن است که خوردگی اتفاق بیفتد.
سری گالوانیک
همهٔ فلزات میتوانند در یک سری گالوانیک دستهبندی شوند که در آن پتانسیل الکتریکی هر فلز در یک الکترولیت در مقابل یک الکترود مرجع را نشان میدهد. تفاوت جایگاه دو فلز در این سری به خوبی نشان میدهد که کدام فلز احتمالاً سریع تر دچار خوردگی میشود. اگر چه عوامل دیگری همچون میزان اکسیژن آب و همچنین نرخ دبی آب در طول فرایند خوردگی نیز در این سرعت تأثیرگذار هستند.[۱]
منابع
↑ ۱٫۰۱٫۱ نویسندگان ویکیپدیا انگلیسی
↑ Decker, Franco (January 2005). "Volta and the 'Pile'". Electrochemistry Encyclopedia. Case Western Reserve University. Archived from the original on 2012-07-16.
↑ M. Houser, Corrosion Control Services, Inc. , introduction handbook
↑ Corrosion Doctors [1] (Retrieved January 2011)
↑ Copper.org [2] (Retrieved January 2011)
↑ Bryant, Arthur (1935). Samuel Pepys: The Years of Peril. Cambridge: Macmillan. p. 370
↑ "Galvanic corrosion... What it is and how to fight it". Motorboating. Hearst Magazines Inc. 82 (1): 50. July 1948.
↑ Trethewey, K.R. ; Chamberlain, J. (1988). "Historic Corrosion Lessons". Corrosion Doctors. Retrieved 2014-02-27.
↑ Water. Hemat, R.A.S. Editor: Urotext. ISBN 1-903737-12-5. p. 826
- Mars Guy Fontana, Corrosion Engineering, McGraw Hill, 1986. p 41.
- رحیم زمانیان، خوردگی و روشهای کنترل آن، انتشارات دانشگاه تهران، ۱۳۷۴
| این یک مقالهٔ خرد پیرامون مهندسی مواد است. با گسترش آن به ویکیپدیا کمک کنید. |
رده:
- خوردگی
(window.RLQ=window.RLQ||[]).push(function()mw.config.set("wgPageParseReport":"limitreport":"cputime":"0.136","walltime":"0.203","ppvisitednodes":"value":917,"limit":1000000,"ppgeneratednodes":"value":0,"limit":1500000,"postexpandincludesize":"value":9010,"limit":2097152,"templateargumentsize":"value":1019,"limit":2097152,"expansiondepth":"value":13,"limit":40,"expensivefunctioncount":"value":2,"limit":500,"unstrip-depth":"value":0,"limit":20,"unstrip-size":"value":3400,"limit":5000000,"entityaccesscount":"value":0,"limit":400,"timingprofile":["100.00% 155.514 1 -total"," 46.97% 73.040 6 الگو:به_زبان_دیگر"," 43.50% 67.652 6 الگو:Lang"," 42.05% 65.389 1 الگو:انگلیسی"," 40.01% 62.227 6 الگو:گرداننده_رده"," 17.91% 27.857 1 الگو:پانویس"," 9.35% 14.541 5 الگو:به_انگلیسی"," 8.84% 13.741 1 الگو:مواد-خرد"," 4.96% 7.707 1 الگو:الگوی_خرد"," 4.81% 7.488 12 الگو:ISO_639_name"],"scribunto":"limitreport-timeusage":"value":"0.022","limit":"10.000","limitreport-memusage":"value":985566,"limit":52428800,"cachereport":"origin":"mw1320","timestamp":"20190308042141","ttl":2592000,"transientcontent":false););"@context":"https://schema.org","@type":"Article","name":"u062eu0648u0631u062fu06afu06cc u06afu0627u0644u0648u0627u0646u06ccu06a9","url":"https://fa.wikipedia.org/wiki/%D8%AE%D9%88%D8%B1%D8%AF%DA%AF%DB%8C_%DA%AF%D8%A7%D9%84%D9%88%D8%A7%D9%86%DB%8C%DA%A9","sameAs":"http://www.wikidata.org/entity/Q2367906","mainEntity":"http://www.wikidata.org/entity/Q2367906","author":"@type":"Organization","name":"Contributors to Wikimedia projects","publisher":"@type":"Organization","name":"Wikimedia Foundation, Inc.","logo":"@type":"ImageObject","url":"https://www.wikimedia.org/static/images/wmf-hor-googpub.png","datePublished":"2009-05-06T10:17:57Z","dateModified":"2018-08-20T04:03:33Z"(window.RLQ=window.RLQ||[]).push(function()mw.config.set("wgBackendResponseTime":116,"wgHostname":"mw1257"););