شیمی محتویات واژهشناسی پیشینه اصول شیمی مدرن بخشهای اصلی جستارهای وابسته منابع پیوند به بیرون منوی ناوبریو10.1007/s00897980249a"A Brief History of the Development of Periodic Table"Note"Dmitri Mendeleev""Official SI Unit definitions"American Scientist Onlineاصول، الگوها و کاربردهای شیمی عمومیووsh850229864009816-3cb119704650(دادهها)825900564393
شیمی
اخترفیزیککیهانشناسیاخترشناسی کهکشانیزمینشناسی سیارهایسیارهشناسیاخترشناسی ستارگانکالبدشناسیاخترزیستشناسیبیوشیمیمهندسی زیستیبیوفیزیکعصبشناسی رفتاریزیستفناوریگیاهشناسیزیستشناسی سلولیسرمازیستشناسیزیستشناسی رشدبومشناسیاتنوبیولوژیزیستشناسی تکاملیمقدمهژنتیکمقدمهپیریشناسیایمنیشناسیلیمنولوژیزیستشناسی دریاییمیکروبشناسیزیستشناسی مولکولیعصبشناسیدیرینشناسیانگلشناسیفیزیولوژیرادیوبیولوژیزیستشناسی خاکزیستشناسی نظریسمشناسیجانورشناسیکیمیاشیمی تجزیهاخترشیمیزیستشیمیبلورنگاریشیمی محیط زیستشیمی خوراکزمینشیمیشیمی سبزشیمی معدنیدانش موادفیزیک مولکولیشیمی هستهایشیمی آلیفوتوشیمیشیمیفیزیکشیمی تابشیشیمی حالت جامدشیمی فضاییشیمی فراذرهایعلم سطحشیمی نظریعلوم جویبومشناسیعلم محیط زیستژئودزیزمینشناسیژئومورفولوژیژئوفیزیکیخشناسیآب شناسیلیمنولوژیکانیشناسیاقیانوسسنجیاقلیمشناسیپالینولوژیجغرافیای فیزیکیخاکشناسیفضاشناسیفیزیک کاربردیفیزیک اتمیفیزیک محاسباتیفیزیک ماده چگالفیزیک تجربیمکانیکفیزیک ذراتفیزیک پلاسمامکانیک کوانتومیمقدمهمکانیک جامداتفیزیک نظریترمودینامیکانتروپینسبیت عامنظریه-امنسبیت خاصمردمشناسیباستانشناسیجرمشناسیجمعیتشناسیاقتصادجغرافیاتاریخزبانشناسیعلوم سیاسیروانشناسیجامعهشناسیحقوقمهندسی کشاورزیمهندسی هوافضامهندسی پزشکیمهندسی شیمیمهندسی عمرانمهندسی کامپیوترمهندسی برقمهندسی محافظت از آتشمهندسی ژنتیکمهندسی صنعتیمهندسی مکانیکمهندسی نظامیمهندسی معدنمهندسی هستهایمهندسی نرمافزارمهندسی زیستیدندانپزشکیاپیدمیولوژیمراقبتهای بهداشتیپزشکیپرستاریداروسازیمددکاری اجتماعیدامپزشکیعلوم رایانهریاضیاتمنطق ریاضیآمار ریاضیفیزیک کاربردیهوش مصنوعیزیستاخلاقبیوانفورماتیکزیستجغرافیامهندسی پزشکیآمارزیستیعلوم شناختیزبانشناسی محاسباتیعلوم فرهنگیسایبرنتیکمطالعات محیطزیستقومشناسیروانشناسی تکاملیجنگلداریسلامتیکتابداریمنطقزیست ریاضیفیزیک ریاضیمدلسازیمهندسی عصبیعصبشناسیاقتصاد سیاسیمطالعات علم و فناوریمطالعات علمینشانهشناسیسوسیوبیولوژینظریه سامانههامیانرشتهایبرنامهریزی شهریChimieChemistryدانشهای بنیادینساختارخواصترکیباتدگرگونیمادهمصری باستانتسلط ایرانیان بر مصر۵۲۰ پیش از میلادیونانیان۳۳۰ پیش از میلادیونانیخلافت اسلامیخاور میانهجنگهای صلیبیانگلیسیزبان فارسیمیرزا صالح شیرازیدارالفنونکیمیاگراننظریه اتمیتئوریاتماصل بقای جرمواکنش شیمیاییانرژیرابطهجرمیونمولکولاکسیژنفیلم عکاسیسیلیسیومقانون نسبتهای معینمواد غیر استوکیومتریتعادلترمودینامیکسینتیک شیمیاییشیمی فیزیکفیزیکمکانیک کوانتومشهودیتئوری کاری دانسیتهاربیتال اتمیمکانیک کوانتومطیف نماییرزونانس مغناطیسی هستهاینظریه نسبیتساختار شیمیاییساختار کریستالیپیوندهای شیمیایینیتروژندیانایفرمول ساختاریالکترونهافریدریش آگوست ککیولهآرچیبالد اسکات کوپرالکساندر بوتلروفترکیبات شیمیاییظرفیت شیمیاییاشیاء فیزیکینورصداحتی در حالت سکونذرات زیراتمیهستهپروتوننوترونالکترونمدارذرات بدون جرمفوتونهاکوارکهالپتونهایونانیمکتب اتم گراییتاریخ باستانهوشتانهاوستانوسخشایارشایونانپلینیوسفیثاغورثامپدکلسدموکریتافلاطونیونان باستانلئوکیپوسدموکریتهندهندوئیسموایشِشیکاکانادالکترونهابار الکتریکیپروتوننوترونیونبار الکتریکیایزوتوپاتمهایپروتونهایهستهیعدد اتمینوترونایزوتوپهایواکنش شیمیاییماده شیمیاییهیدروژناکسیژناتممولکولیفرمول شیمیاییهیدروژن پراکسیدترکیبهای شیمیاییتجزیهبرقکافتاکسیژناکسیژندگرشکلیالماسگرافیتگوگردفسفرهسته اتمهایواکنش هستهایتبدیل هستهایایزوتوپ پایدارتکنسیمپرومتیمبیسموتماده شیمیاییعنصر شیمیاییپیوند شیمیاییواکنش شیمیاییساختمان شیمیاییپیوند شیمیاییمولکولیپیوند کووالانسینمکپیوند یونیفلزاتپیوند فلزیکمپلکس شیمیاییپیوند داتیوعناصر شیمیاییمولکولمادهٔ شیمیاییاتمپیوند شیمیاییگازهای بیاثرآبهیدروژناکسیژنفرمول شیمیاییاتانولدیمتیل اترایزومرمولکربن-۱۲عدد آووگادروهواآلیاژهاهمگنمادهاتمهامولکولهاپیوند کووالانسیپیوند الکترووالانسیپیوند یونیپیوند فلزینیروی واندروالسیپیوند هیدروژنیمولکول جور هستهمولکول ناجور هستهاستحکام پیوندالکترونگاتیویماکرومولکولهاانرژیسامانهانرژی جنبشیانرژی پتانسیلانرژی گرماییانرژی الکترومغناطیسیانرژی شیمیاییانرژی الکتریکیانرژی هستهایانرژی هستهایخورشیدماده شیمیاییفیزیکیاتمهاآرایش الکترونیترکیبتجزیهبازآراییانرژیگرمانورصوتگازرسوبیوناتممولکولهاییبار الکتریکیالکترونهاپروتونهافیزیکیشیمیایییونیزاسیونپدیدهکاتیونآنیونترکیبات یونینمکپلاسماواکنش اسید و بازاسیدبازآنتوان لاووازیهسوانت آرنیوسمحلول آبیاز هم جداثابت جداسازیمولکول آبهیدرونیومواکنش اسید-بازنظریه اسید-باز برونستد-لوریاسیدپروتونبازاسید استیکآباستیک اسیدطبق نظریهٔ لوییسجفت الکترون غیر پیوندیمولکولاسیدبازگیلبرت لوویساکسایش-کاهشواکنشهای شیمیاییعدد اکسایشکربنکربن دیاکسیدمتانبدن انسانالکترونمولکولیوناتماکسیژناتممولکولالکترونهاتعادل شیمیاییفعالیت شیمیاییواکنش شیمیاییترمودینامیکیانرژی آزاد گیبسانرژیانتروپیسیستمدماحجمفشارقانون شیمیاییپایستگی جرمواکنش شیمیاییپایستگی انرژیتعادلترمودینامیکسینتیکاشعه ایکسآلفابتاگاماشیمی کشاورزیاخترشیمیکیهانشیمیشیمی جومهندسی شیمیزیستشناسی شیمیاییشیمیانفورماتیکالکتروشیمیشیمی محیط زیستفمتوشیمیزمینشیمیشیمی سبزایمونوهیستوشیمیتاریخ شیمیهیدروژنه کردنایمونوشیمیشیمی دریاییعلم موادشیمی ریاضیاتیمکانوشیمیاییشیمی داروییزیستشناسی مولکولیمکانیک مولکولیفناوری نانوفراورده طبیعیمیشناسیشیمی آلی فلزیپتروشیمیداروشناسیفوتوشیمیشیمی آلی فیزیکیفیتوشیمیشیمی بسپارپرتوشیمیشیمی حالت جامدآواشیمیشیمی فراذرهایعلم سطحسنتز شیمیاییترموشیمیصنایع شیمیاییصنایعمواد شیمیاییپالایشگاههاواحدهای پتروشیمیخام نفتیحلال (محصولات غذایی)رزیناخترشناسیزیستشناسیشیمیعلوم زمینفیزیک
شیمی
پرش به ناوبری
پرش به جستجو

شیمی مطالعهٔ شکل وساختار، خواص، ترکیبات، و تغییر شکل مواد است.
 |
| بخشی از نوشتارها در مورد علم |
علوم طبیعی اخترشناسی زیستشناسی شیمی علوم زمین فیزیک |
علوم اجتماعی و علوم انسانی مردمشناسی • باستانشناسی فلسفه • علوم ارتباطات |
علوم کاربردی مهندسی علوم سلامت |
علوم صوری علوم رایانه |
عنوانهای مربوط میانرشتهای تاریخ علم |
شیمی (به فرانسوی: Chimie) (به انگلیسی: Chemistry) یکی از دانشهای بنیادین است که به مطالعه و بررسی ساختار، خواص، ترکیبات، و دگرگونی ماده میپردازد. گسترهٔ زیاد این دانش باعث شدهاست تا تعریف یکپارچه برای آن مشکل گردد.
محتویات
۱ واژهشناسی
۲ پیشینه
۲.۱ شیمی به عنوان علم
۲.۲ ساختار شیمیایی
۳ اصول شیمی مدرن
۳.۱ ماده
۳.۱.۱ اتم
۳.۱.۲ عنصر
۳.۱.۳ ترکیب
۳.۱.۴ مولکول
۳.۱.۵ مول و مقدار مواد
۳.۱.۶ مواد خالص و مخلوط
۳.۲ فاز (ماده)
۳.۳ پیوند شیمیایی
۳.۴ انرژی
۳.۵ واکنش شیمیایی
۳.۶ یونها و نمکها
۳.۷ واکنش اسید و باز
۳.۸ اکسایش-کاهش
۳.۹ تعادل شیمیایی
۳.۱۰ قانون شیمیایی
۴ بخشهای اصلی
۴.۱ رشتهها
۴.۲ صنایع شیمیایی
۴.۳ جوامع حرفهای
۵ جستارهای وابسته
۶ منابع
۷ پیوند به بیرون
واژهشناسی
واژهٔ شیمی از کیمیا در زبان [[زبان مصری باستان، کیمیا از واژهٔ خامه یا خَمِه به معنای زمینِ سیاه برگرفته شدهاست. پس از تسلط ایرانیان بر مصر در ۵۲۰ پیش از میلاد، این واژه به صورت کیمیا به شرق آمدهاست و پس از تسلط یونانیان در ۳۳۰ پیش از میلاد به صورت خومِیا (به یونانی: χυμεία) در یونانی نیز وارد گردیدهاست. در دوران تسلط خلافت اسلامی در خاور میانه، به صورت الکیمیاء درآمدهاست و با جنگهای صلیبی به صورت الشمی(به انگلیسی: Alchemy) مجدداً است. در زبان فارسی، شیمی یک ترانویسی از برابر فرانسوی است و نخستین بار در سال ۱۸۳۱ توسط میرزا صالح شیرازی در یک رسالهٔ علوم طبیعی که خود وی مرقوم داشته بود بهکار برده شد که بعدها در مدرسهٔ دارالفنون با عنوان رسالهٔ طبیعیات تدریس میگردید.
پیشینه

دموکریت، مهمترین شارح و بسطدهندهٔ افکار لئوکیپوس دربارهٔ اتمگرایی بود.

جابر بن حیان، او را «پدر علم شیمی» نامیدهاند و اولین کسی است که به علم شیمی شهرت و آوازه بخشید.
کوششهای نخستین بشر برای فهمیدن طبیعت مواد و بیان چگونگی دگرگونی آنها ناموفق بود. اندک اندک کوششها برای تبدیل مواد کم ارزش، به مواد ارزشمندی چون زر و سیم، منجر به پیدایی دانش کیمیا گردید. هر چند در ظاهر دانش کیمیا به خواست اصلی خود نرسید، اما دستاوردهای کیمیاگران در این راه به اندوخته گرانبهایی تبدیل شد که پایهگذار شیمی مدرن گردید.[۱]
شیمی به عنوان علم

آنتوان لاووازیه به عنوان پدر شیمی نوین شناخته میشود.".[۲]

دمیتری مندلیف در جدول تناوبی خود ۷ عنصر جدید را پیشبینی کرد،[۳] و ۶۰ عنصر را در جای درست قرار داده بود.[۴]
نظریه اتمی پایه و اساس علم شیمی است. این تئوری بیان میدارد که تمام مواد از واحدهای بسیار کوچکی به نام اتم تشکیل شدهاند. یکی از اصول و قوانینی که در مطرح شدن شیمی به عنوان یک علم تأثیر بهسزایی داشته، اصل بقای جرم است. این قانون بیان میکند که در طول انجام یک واکنش شیمیایی معمولی، مقدار ماده تغییر نمیکند. (امروزه فیزیک مدرن ثابت کرده که در واقع این انرژی است که بدون تغییر میماند و همچنین انرژی و جرم با یکدیگر رابطه دارند)
این مطلب بهطور ساده به این معنی است که اگر دههزار اتم داشته باشیم و مقدار زیادی واکنش شیمیایی انجام پذیرد، در پایان ما همچنان بطور دقیق دههزار اتم خواهیم داشت. اگر انرژی از دست رفته یا بهدستآمده را مد نظر قرار دهیم، مقدار جرم نیز تغییر نمیکند. شیمی کنش و واکنش میان اتمها را به تنهایی یا در بیشتر موارد بههمراه دیگر اتمها و بهصورت یون یا مولکول (ترکیب) بررسی میکند.
این اتمها اغلب با اتمهای دیگر واکنشهایی را انجام میدهند. (برای نمونه زمانیکه آتش چوب را میسوزاند واکنشی است بین اتمهای اکسیژن موجود در هوا و مواد آلی چوب؛ که نور بر روی مواد شیمیایی فیلم عکاسی ایجاد میکند شکل میگیرد)
یکی از یافتههای بنیادین و جالب دانش شیمی این بودهاست که اتمها رویهمرفته همیشه به نسبت برابر با یکدیگر ترکیب میشوند. سیلیس دارای ساختمانی است که نسبت اتمهای سیلیسیوم به اکسیژن در آن یک به دو است. امروزه ثابت شدهاست که استثناهایی در زمینهٔ قانون نسبتهای معین وجود دارد(مواد غیر استوکیومتری).
یکی دیگر از یافتههای کلیدی شیمی این بود که زمانی که یک واکنش شیمیایی مشخص رخ میدهد، مقدار انرژی که بدست میآید یا از دست میرود همواره یکسان است. این امر ما را به مفاهیم مهمی مانند تعادل، ترمودینامیک و سینتیک شیمیایی میرساند.
شیمی فیزیک بر پایهٔ فیزیک پیشرفته (مدرن) بنا شدهاست. اصولاً میتوان تمام سیستمهای شیمیایی را با استفاده از تئوری مکانیک کوانتوم شرح داد. این تئوری از لحاظ ریاضی پیچیده بوده و عمیقاً شهودی است. به هر حال در عمل و بطور واقعی تنها بررسی سیستمهای سادهٔ شیمیایی قابل بررسی با مفاهیم مکانیکی کوانتوم امکانپذیر است و در اکثر مواقع باید از تقریب استفاده کرد (مانند تئوری کاری دانسیته). بنابراین درک کامل مکانیک کوانتوم برای تمامی مباحث شیمی کاربرد ندارد؛ زیرا نتایج مهم این تئوری (بخصوص اربیتال اتمی) با استفاده از مفاهیم سادهتری قابل درک و بهکارگیری هستند.
با اینکه در بسیاری موارد ممکن است مکانیک کوانتوم نادیده گرفته شود، اما از مفهوم اساسی آن، یعنی کوانتومی کردن انرژی، نمیتوان صرف نظر کرد. شیمیدانها برای بکارگیری کلیه روشهای طیف نمایی به آثار و نتایج کوانتوم وابستهاند. علم فیزیک هم ممکن است مورد بیتوجهی واقع شود، اما به هر حال برآیند نهایی آن (مانند رزونانس مغناطیسی هستهای) پژوهیده و مطالعه میشود.
یکی دیگر از تئوریهای اصلی فیزیک مدرن که نباید نادیده گرفته شود نظریه نسبیت است. این نظریه که از دیدگاه ریاضی پیچیدهاست، شرح کامل فیزیکی علم شیمی است. مفاهیم نسبیتی تنها در برخی از محاسبات خیلی دقیق ساختمان هسته، بهویژه در عناصر سنگینتر، کاربرد دارند و در عمل تقریباً با شیمی پیوند ندارند.
ساختار شیمیایی

آزمایشگاه، مؤسسه بیوشیمی، دانشگاه کلن در آلمان.
ساختار شیمیایی شامل هندسهٔ مولکولی، ساختار الکترونی و ساختار کریستالی مولکول است. هندسه مولکولی اشاره به آرایش فضایی اتمها در یک مولکول و نحوهٔ چیدمان پیوندهای شیمیایی اتمها باهم میباشد. هندسهٔ مولکولی میتواند بسیار ساده باشد، مانند اکسیژن دواتمی یا مولکولهای نیتروژن، یا بسیار پیچیده باشد مانند پروتئینها یا مولکول دیانای. هندسه مولکولی را میتوان تقریباً با استفاده از یک فرمول ساختاری نشان داد. ساختار الکترونی توصیف اشغال اوربیتالهای مولکولی یک مولکول توسط الکترونها است.
نظریهٔ ساختار شیمیایی در دهههای ۱۸۵۰ و ۱۸۶۰ توسط شیمیدانهای مختلف، از جمله فریدریش آگوست ککیوله، آرچیبالد اسکات کوپر و الکساندر بوتلروف توسعه داده شد. این شیمیدانان نشان دادند که ترکیبات شیمیایی از گروههای فرعی و گروههای عاملی تشکیل شدهاند، اما ساختار با نظم مشخصی بر اساس ظرفیت ظرفیت شیمیایی اتمها شکل گرفتهاند.
اصول شیمی مدرن
ماده
ماده بهطور کلی تمام آن چیزی است که اشیاء فیزیکی شامل آن میشوند.
تا پیش از سدهٔ بیستم میلادی، اصطلاح ماده شامل مادهٔ معمولی تشکیل شده از اتمها بود و دیگر پدیدههای انرژی مانند نور یا صدا را در بر نمیگرفت. این مفهوم از ماده، اکنون به هر گونه چیزی که دارای جرم، حتی در حالت سکون، گسترش یافته ولی این تعریفها نارسا است زیرا جرم یک شیء خود میتواند در نتیجهٔ حرکت و تعامل انرژیهای (احتمالاً بدون جرم) بوجود آید.
همهٔ چیزهایی را که در زندگی روزمره میتوانیم لمس کنیم از اتمها تشکیل شدهاند. این مادههای ساخته شده از اتمها، که آنها هم به نوبهٔ خود از تعامل ذرات زیراتمی شکل گرفتهاند معمولاً از یک هسته، محتوی پروتون و نوترون، و ابری از الکترون در مدار پیرامون هسته ساخته شدهاند.
ذرات بدون جرم، مانند فوتونها، ماده در نظر گرفته نمیشوند، چرا که آنها نه جرم و نه حجم دارند. با این حال، تمام ذرات با جرم هم، دارای حجم (به معنی کلاسیک) نیستند، زیرا ذرات بنیادی مانند کوارکها و لپتونها (که گاهی اوقات با ماده برابرند) «ذراتی نقطهای» در نظر گرفته شدهاند که اندازه و حجم مؤثری ندارند. با این وجود، کوارکها و لپتونها با هم «ماده معمولی» را تشکیل میدهند، و اثر متقابل آنهاست که به ایجاد حجم مؤثر در ذرات مرکب که ماده معمولی را میسازند کمک میکند.[۵][۶]
اتم

مدل اتمی رادرفورد
اتم (به یونانی: Άτομο به معنی «ناگسستنی (تجزیه ناپذیر)») کوچکترین واحد تشکیل دهنده یک مادهٔ ساده است که میتواند به کمک پیوند شیمیایی به اتمی دیگر متصل گردد.[۷] تئوری مکتب اتم گرایی که از عقیدهٔ تشکیل مواد از ریزدانههای نادیدنی (در برابر عقیده به تفکیکپذیر بودن مواد به ذرات نامتناهی) دفاع میکرد از تاریخ باستان شناخته شده بود.
ابتدا توسط هوشتانه (به یونانی اوستن یا اوستانوس) که در لشگرکشی خشایارشا به یونان با او همراه بود و در آنجا به آموزش کیمیا میپرداخت طرح گردید.[۸] مکتب آموزشی او چنان مورد استقبال قرار گرفت که بنا به گفتهٔ پلینی(پلینیوس)، بسیاری از فیلسوفان یونان همچون فیثاغورث، امپدکلس، دموکریت، و افلاطون برای مطالعهٔ آن به خارج سفر کردند.[۹][۱۰] پس از او توسط فلاسفهٔ یونان باستان از جمله لئوکیپوس و شاگرد وی دموکریت و همچنین بعدها در هند و در یکی از شش مدرسهٔ هندوئیسم یعنی وایشِشیکا که توسط کاناد بنیان نهاده شده بود، تدریس میشد.
اتم از یک هسته مرکزی با بار مثبت محاطه شده با ابر الکترونی با بار منفی تشکیل شدهاست. تعریف دیگری آن را به عنوان کوچکترین واحدی در نظر میگیرد که ماده را میتوان به آن تقسیم کرد بدون اینکه اجزاء بارداری از آن خارج شود.[۱۱] اتم ابری الکترونی، تشکیلشده از الکترونها با بار الکتریکی منفی، که هستهٔ اتم را احاطه کردهاست. هسته نیز خود از پروتون که دارای بار مثبت است و نوترون که از لحاظ الکتریکی خنثی است تشکیل شدهاست. زمانی که تعداد پروتونها و الکترونهای اتم با هم برابر هستند اتم از نظر الکتریکی در حالت خنثی یا متعادل قرار دارد در غیر این صورت آن را یون مینامند که میتواند دارای بار الکتریکی مثبت یا منفی باشد. اتمها با توجه به تعداد پروتونها و نوترونهای آنها طبقهبندی میشوند. تعداد پروتونهای اتم مشخصکننده نوع عنصر شیمیایی و تعداد نوترونها مشخصکننده ایزوتوپ عنصر است.[۱۲]
عنصر
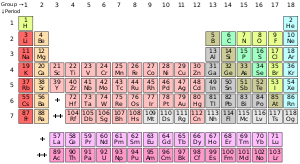
فرم استاندارد جدول جدول تناوبی عناصر شیمیایی. رنگها نشان دهنده دستههای مختلف عناصر هستند
عنصر در دانش شیمی به مادهای گفته میشود که اتمهای آن تعداد پروتونهای برابر در هستهی خود داشته باشند. این عدد (تعداد پروتونها) که با نماد Z نشان داده میشود، عدد اتمی آن عنصر نام دارد. همه اتمهایی که دارای تعداد پروتونهای برابر (عدد اتمی برابر) باشند، ویژگیهای شیمیایی یکسانی دارند. اما اتمهای یک عنصر میتوانند دارای تعداد متفاوتی نوترون باشند که ایزوتوپهای آن عنصر نامیده میشوند. گاهی نیز برای سادگی، به عنصر شیمیایی صرفاً عنصر گفته میشود. ویژگیهای شیمیایی اتمهای یک عنصر توسط ساختار الکترونی آنها تعیین میشود که آن نیز به تعداد پروتونهای هسته آن اتم وابسته است.
عناصر شیمیایی میتوانند در هنگام واکنش شیمیایی با یکدیگر ترکیب شده و تعداد بیشماری ماده شیمیایی بوجود آورند. مثلاً آب نتیجه واکنش عنصرهای هیدروژن و اکسیژن است. در این حالت، دو اتم هیدروژن و یک اتم اکسیژن به هم متصل میشوند و مولکولی با فرمول شیمیایی H2O میسازند. همین دو عنصر در شرایط متفاوت میتوانند مادهٔ دیگری را به نام هیدروژن پراکسید (آب اکسیژنه) بسازند که دارای مولکولهای H2O2 است. به همین شکل، همه ترکیبهای شیمیایی میتوانند به عناصر سازنده خود تجزیه شوند. به عنوان مثال میتوان آب را به کمک برقکافت به عناصر هیدروژن و اکسیژن تبدیل کرد.

نماد عناصر چهارگانه در یونان باستان
یک ماده خالص که تنها از اتمهای یک عنصر تشکیل شده باشد، «ماده ساده» نامیده میشود. چنین مادهای را نمیتوان به ماده دیگری تجزیه کرد. از این دیدگاه، ماده ساده در برابر ماده مرکب قرار میگیرد. به عنوان مثال، اکسیژن یک عنصر است. اما مادهای را که ما در طبیعت به عنوان گاز اکسیژن شناختهایم، در حقیقت یک ماده ساده دو اتمی از این عنصر است که «دی اکسیژن» یا «اکسیژن مولکولی» (O2) نامیده میشود. اوزون شکل دیگری از عنصر اکسیژن است که در طبیعت با فرمول (O3) یافت میشود. رابطه بین دی اکسیژن و اوزون رابطهای است که به آن دگرشکلی (آلوتروپی) میگویند. به زبان دیگر، دی اکسیژن و اوزون، دگرشکلهای عنصر اکسیژن هستند. الماس و گرافیت نیز دو آلوتروپ برای عنصر کربن هستند. عناصر دیگر مانند گوگرد و فسفر هم دارای آلوتروپهای شناختهشدهٔ پرکاربردی هستند.
عناصر شیمیایی را نمیتوان به کمک واکنشهای شیمیایی معمولی به یکدیگر تبدیل کرد. تنها واکنشی که میتوان با استفاده از آن تعداد پروتونهای هسته اتمهای یک عنصر را تغییر داد و یک عنصر را به عنصر دیگری تبدیل کرد، یک واکنش هستهای است که آن را واکنش تبدیل هستهای مینامند.
تا کنون ۱۱۸ عنصر، کشف یا ساخته شدهاند. از این تعداد، ۹۴ عنصر در طبیعت یافت میشوند و بقیه بهطور مصنوعی و به کمک واکنشهای هستهای در آزمایشگاه ساخته شدهاند. از میان همه عناصر، ۸۰ عنصر دارای حداقل یک ایزوتوپ پایدار میباشند که به جز عنصر شماره ۴۳ (تکنسیم) و عنصر شماره ۶۱ (پرومتیم) همگی دارای عدد اتمی برابر یا پایینتر از ۸۲ هستند. به زبان دیگر در جدول تناوبی تنها عناصری که از عنصر ۸۳ (بیسموت) سبکتر بوده و دارای ایزوتوپ پایدار نمیباشند، تکنسیم و پرومتیم هستند.
ترکیب

کربن دیاکسید (CO2)یک نمونه از ترکیبات
ترکیب شیمیایی عبارت است از یک ماده شیمیایی خالص که از دو یا چند عنصر شیمیایی مختلف تشکیل میشود. این عناصر به وسیلهٔ پیوند شیمیایی به یکدیگر متصل میشوند و میتوانند به وسیله واکنش شیمیایی به مواد ساده تبدیل گردند. هر ترکیب شیمیایی مختلف، یک ساختمان شیمیایی تعریف شده منحصر به فرد دارد؛ به عبارت دیگر، هر ترکیب نسبت اتمی یکسانی دارد که اتمهای آن با چینش مکانی مشخصی به وسیله پیوند شیمیایی آرایش مییابند. ترکیبات شیمیایی ممکن است به صورت ترکیب مولکولی باشند که در این صورت مولکولها با پیوند کووالانسی در کنار هم قرار میگیرند؛ همچنین ممکن است به صورت نمک باشند و به وسیله پیوند یونی به هم پیوند یابند؛ اگر ترکیب مورد نظر تنها شامل فلزات باشد، پیوند بین ذرههای آن پیوند فلزی و اگر کمپلکس شیمیایی باشد، پیوند بین ذرات آن پیوند داتیو خواهد بود. عناصر شیمیایی خالص، در گروه ترکیبات شیمیایی قرار نمیگیرند، حتی اگر از دو یا چند اتم از یک نوع عنصر (مانند H۲ و S۸) تشکیل شده باشند که پیوندهای دو اتمی یا چند اتمی نامیده میشوند.
مولکول

مدل گلوله و میله مولکول کافئین (C8H10N4O2).

فرمول اسکلتی بنزن (C6H6)
مولکول کوچکترین ذرهٔ یک مادهٔ شیمیایی خالص است که ویژگیهای آن ماده را دارد. یک مولکول از دو یا چند اتم تشکیل شده که با پیوند شیمیایی به هم متصلند. البته مولکول بعضی عناصر (همچون گازهای بیاثر) تنها از یک اتم تشکیل شدهاست.
اتمهای یک مولکول میتواند از یک نوع یا از چند نوع باشد.
نسبت اتمها در یک مولکول خاص همیشه ثابت است. برای مثال در مولکول آب نسبت اتمهای هیدروژن به اکسیژن همیشه ۲ است. تعداد اتمهای موجود در یک مولکول به وسیلهٔ فرمول شیمیایی آن نشان داده میشود. فرمول شیمیایی به تنهایی نشان دهندهٔ ویژگیهای ماده نیست. ممکن است دو ماده فرمول شیمیایی یکسانی داشته باشند، اما ویژگیهای آنها کاملاً متفاوت باشد. برای مثال اتانول و دیمتیل اتر فرمول شیمیایی یکسان اما خواص شیمیایی متفاوت دارند. به این مواد ایزومر گفته میشود.
مول و مقدار مواد
مول مقداری از هر ماده است که تعداد ذرات بنیادی آن (مولکول یا اتم) برابر با تعداد اتمهای موجود در ۱۲ گرم از کربن-۱۲ است.
این تعداد، عدد آووگادرو نامیده شده و برابر است با ۱۰۲۳ × ۶٫۰۲۲۱۴۱۹۹. که در واقع مقداری از جسم که تعداد واحدهای بنیادی آن برابر با عدد آووگادرو باشد، یم مول است که به صورت واحد SI بهشمار میرود.[۱۳]
مواد خالص و مخلوط
  | |
  | |
  | |
نمونههایی از مواد شیمیایی خالص از چپ به راست: عناصر قلع (Sn) و گوگرد (S), الماس (به عنوان دگرشکلی از کربن), ساکارز (شکر خالص), و سدیم کلرید (نمک) و بیکربنات سدیم (جوش شیرین), که ترکیبات یونی هستند. |
مواد خالص مادهای است که تنها از یک جزء ساخته شدهاند به عبارت دیگر ماده خالص مادهای است که تنها از یک نوع عنصر یا یک نوع ماده مرکب تشکیل شدهاست.[۱۴] مجموعهای از مواد خالص مواد مخلوط را تشکیل میدهند. هوا و آلیاژها نمونههایی از مخلوطها هستند.[۱۵]
فاز (ماده)

مثالی از تغییرات فاز
به قسمتی همگن و مشخص از یک ماده که در آن خواص فیزیکی و ساختار شیمیایی به صورت پیوسته (نه گسسته) تغییر کند، فاز گفته میشود. هر فاز توسط مرزهای حقیقی از فازهای مجاور خودش جدا میشود که به ان فصل مشترک میگویند که در این مرزها خواص به صورت گسسته تغییر میکنند.
پیوند شیمیایی

فرایند پیوند یونی بین سدیم (Na) و کلر (Cl) به شکل سدیم کلرید یا نمک خوراکی. پیوند یونی جاذبه بین یونهای با بار ناهمنام است.
پیوند شیمیایی به نیروهایی که اتمها یا مولکولها را کنار هم نگه میدارد گفته میشود و بر دو دستهاند: پیوندهای میان اتمی: شامل پیوند کووالانسی - پیوند الکترووالانسی (پیوند یونی) - پیوند فلزی و پیوندهای میان مولکولی: نیروی واندروالسی - پیوند هیدروژنی
این پیوندها میتواند بین دو اتم یکسان یا دو اتم متفاوت باشد که در حالت اول آن را مولکول جور هسته و در حالت دوم آن را مولکول ناجور هسته مینامند. استحکام پیوند شیمیایی را الکترونگاتیوی (یا الکترونگاتیویته) تعیین میکند. تعداد پیوندهای شیمیایی در مولکولهای مختلف متفاوت است و از یک پیوند در مولکولهای سادهٔ دو اتمی تا پیوندهای بسیار در ماکرومولکولها را شامل میشود.[۱۶][۱۷]
انرژی
انرژی خاصیتی از جسم است که قابل انتقال به اشیای دیگر یا قابل تبدیل به حالتها و شکلهای مختلف است. انرژی کمیتی بنیادین است که برای توصیف وضعیت یک ذره، شیئ یا سامانه به آن نسبت داده میشود.
گونههای متفاوتی از انرژی شناخته شده و به دستههای متفاوتی طبقهبندی میشوند از آن جمله میتوان انرژی جنبشی، انرژی پتانسیل، انرژی گرمایی، انرژی الکترومغناطیسی، انرژی شیمیایی
و انرژی الکتریکی و انرژی هستهای را نام برد. بجز انرژی هستهای منبع همه گونه انرژیهایی که بشر از آن استفاده میکند خورشید است.
واکنش شیمیایی

واکنش ترمایت با استفاده از اکسید آهن (III).
واکنش شیمیایی فرایندی است که در آن ساختار ذرههای تشکیل دهندهٔ مواد اولیه دچار تغییر میشود؛ یعنی طی آن یک یا چند ماده شیمیایی به یک یا چند ماده شیمیایی دیگر تبدیل میشود. تغییراتی که در واکنشی بر روی مواد واکنشدهنده صورت میگیرد، بطور کلی به دو نوع تغییرات فیزیکی و شیمیایی تقسیم میشوند.
در تغییرات شیمیایی اتصال اتمها به یکدیگر و آرایش الکترونی آنها در واکنشدهندهها تغییر مییابد. البته در یک واکنش شیمیایی، اتمها نه بهوجود میآیند و نه از بین میروند و تنها ترکیب، تجزیه یا بازآرایی میشوند. واکنش شیمیایی بیان یک تغییر شیمیایی است که ممکن است با آزاد کردن انرژی به صورت گرما، نور یا صوت همراه باشند و تولید گاز، تشکیل رسوب یا تغییر رنگ در پی داشته باشند.
یونها و نمکها

ساختار شبکه بلوری ترکیب سدیم کلرید(NaCl) که نمونهای از یک ترکیب یونی است. در این نگاره گوی ارغوانی رنگ نمایانگرکاتیونهای سدیم (Na+) و گوی سبز نشاندهندهٔ آنیونهای کلرید (Cl−)
یون به اتم یا مولکولهایی گفته میشود که بار الکتریکی اضافه داشته باشند و این بار میتواند منفی یا مثبت باشد. نابرابری تعداد کل الکترونها با پروتونها، در یک اتم یا مولکول، به آن بار خالص مثبت یا بار خالص منفی الکتریکی میدهد.
با استفاده از روشهای فیزیکی یا شیمیایی، از طریق یونیزاسیون میتوان این پدیده را ایجاد کرد. از نگاه شیمیایی، اگر یک اتم خنثی، یک یا چند الکترون خود را از دست دهد، دارای بار خالص مثبت میشود و به عنوان یک کاتیون شناخته میشود و اگر یک اتم خنثی الکترون بیشتری به دست آورد، دارای بار خالص منفی میشود و به عنوان یک آنیون شناخته شدهاست. به سبب ناهمگونی بار الکتریکی خود، کاتیونها و آنیونها یکدیگر را به آسانی جذب و تشکیل ترکیبات یونی مانند نمک را ممکن میسازند.
پلاسما از مواد گازی تشکیل شدهاست که بهطور کامل در دمای بالا یونیزه شدهاست
واکنش اسید و باز
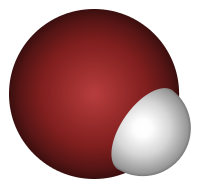
هنگامی که هیدروژن برمید (HBr), در آب حل میشود اسید قوی هیدروبرومیک اسید تشکیل میشود.
واکنش اسید و باز یک واکنش شیمیایی است که میان یک اسید و یک باز اتفاق میافتد. مفاهیم متعددی که تعاریف دیگری از مکانیزم واکنشهای درگیر و کاربرد آنها در حل مسائل وجود دارد. علیرغم تعدد تعاریف مختلف، اهمیت آنها در تجزیه و تحلیل هنگام سر و کار داشتن با واکنشهای اسید و باز در حالتهای گازی یا به خصوص مایع یا حتی در حالتهایی که به ندرت دیدهمیشوند، مشخص میشود. اولین مفاهیم دربارهٔ واکنشهای اسید و باز در حدود سال ۱۷۷۶ توسط آنتوان لاووازیه تنظیم شد.[۱۸]
براساس تعریف سوانت آرنیوس اسید مادهای است که در محلول آبی از هم جدا میشود و یون هیدروژن H+ (یک پروتون) آزاد میکند.[۱۹]
- HA
 A− + H+
A− + H+
ثابت تعادل در اینگونه واکنشهای جداسازی، ثابت جداسازی نام دارد. پروتون آزاد شده با یک مولکول آب وارد واکنش میشود تا یک هیدرونیوم (یا اکسینیوم) یون H۳O+ بدهد. بعدها آرنیوس پیشنهاد کرد که این جداسازی را با نام واکنش اسید-باز شناخته شود.
- HA + H۲O
 A− + H۳O+.
A− + H۳O+.
بر طبق نظریه اسید-باز برونستد-لوری اسید مادهای است که پروتون (H+) از دست میدهد و باز مادهای است که پروتون میگیرد. به عنوان نمونه در واکنش اسید استیک و آب، استیک اسید پروتون از دست داده و آب پروتون میگیرد پس استیک اسید، اسید و آب به عنوان باز عمل میکند.[۲۰][۲۱]طبق نظریهٔ لوییس مولکولی که بتواند جفت الکترون غیر پیوندی از مولکول دیگری دریافت کند اسید و مولکول دهنده جفت الکترون باز است. این نظریه نخستین بار توسط دانشمند مشهور آمریکایی گیلبرت لوویس و در سال ۱۹۲۳ ارائه شد.[۲۲]
اکسایش-کاهش


زنگ زدن، یک واکنش اکسیداسیون آهسته
اکسایش-کاهش نام کلی واکنشهای شیمیایی است که مایه تغییر عدد اکسایش اتمها میشوند. این فرایند میتواند دربرگیرنده واکنشهای سادهای همچون اکسایش کربن و تبدیل آن به کربن دیاکسید و کاهش کربن و تبدیل آن به متان یا واکنشهای پیچیدهای چون اکسایش قند در بدن انسان طی واکنشهای چند مرحلهای باشد.
با کمی اغماض علمی میتوان این فرایند را انتقال یک یا چند الکترون از یک اتم، مولکول یا یون به یک اتم، مولکول یا یون دیگر دانست. در هر واکنش اکسایش و کاهش اتم یا مولکولی الکترون از دست میدهد (اکسایش) و اتم یا مولکولی دیگر الکترون جذب میکند (کاهش) مییابد.
در چنین واکنشی مولکول دهنده اتم اکسیده شده و مولکول گیرنده کاهیده میشود. در واقع تعریف ابتدایی اکسایش واکنش یک ماده با اکسیژن و ترکیب شدن با آن بودهاست، اما با کشف الکترون اصطلاح اکسایش دقیقتر تعریف شد و کلیه واکنشهایی که طی آن مادهای الکترون از دست میدهد اکسایش نامیده شدند. اتم اکسیژن میتواند در چنین واکنشی شرکت داشته یا نداشته باشد. در اثر اکسایش عدد اکسایش معمولی یک اتم یا اتمهای یک مولکول در پی حذف الکترونها افزایش مییابد.
برای نمونه آهن (II) میتواند به آهن (III) اکسید شود.
-Fe2+ → Fe3+ + e
تعادل شیمیایی
تعادل شیمیایی به حالتی گفته میشود که در آن فعالیت شیمیایی و در نتیجه غلظت واکنشگرها و محصولات در واکنش شیمیایی با گذشت زمان تغییر نکند. معمولاً این تعادل در شرایطی حاصل میشود که سرعت واکنش رفت با برگشت برابر باشد.
از دیدگاه ترمودینامیکی تغییرات انرژی آزاد گیبس واکنش در تعادل شیمیایی صفر است. کاهش سطح انرژی و افزایش انتروپی (بینظمی) آن را در دو جهت رفت (مستقیم) و برگشت (معکوس) بهطور همزمان پیش میبرند.
در تعادلهای شیمیایی هیچیک از دو عامل کاهش سطح انرژی و افزایش انتروپی بر دیگری برتری ندارد و به این دلیل تا زمانی که تغییری در شرایط مرزی سیستم رخ ندهد در تعادل خواهد ماند. تغییر دما و حجم و فشار سامانه میتواند آن را از تعادل خارج کند و در این حالت واکنش در جهتی که بتواند تأثیر تغییرات اعمال شده را کاهش دهد، سرعت بیشتری نسبت به دیگری پیدا میکند.
قانون شیمیایی
قانون شیمیایی آن دسته از قانونهای طبیعت اند که با شیمی مرتبطند. پایه ایترین مفهوم در شیمی قانون پایستگی جرم است که بیان میدارد در طی یک واکنش شیمیایی معمولی هیچ جرمی از میان نمیرود. پایستگی انرژی منجر به مفهوم مهم تعادل، ترمودینامیک و سینتیک میشود. واکنشهای شیمیایی تحت قوانین خاصی قرار میگیرند که مفاهیم اساسی در شیمی هستند. بعضی از آنها عبارتند از:
- قانون آووگادرو
- قانون بیر-لامبرت
قانون بویل (۱۶۶۲, مربوط به فشار و حجم)
قانون شارل (۱۷۸۷, مربوط به حجم و دما)- قانون نفوذ فیک
قانون شارل - گیلوساک (۱۸۰۹, مربوط به فشار و دما)- اصل لوشاتلیه
- قانون هنری
- قانون هس
پایستگی انرژی منجر به مفاهیم مهم تعادل شیمیایی، ترمودینامیک، و سینتیک شیمیایی.- پایستگی جرم
- قانون نسبتهای معین
- قانون نسبتهای چندگانه
- قانون رائول
بخشهای اصلی
رشتهها
شیمی تجزیه، که به تعیین ترکیبات مواد و اجزای تشکیل دهنده آنها میپردازد.
شیمی آلی، که به مطالعهٔ میلیونها ترکیب شیمیایی دارای اتمهای عنصر کربن، غیر از ترکیباتی چون دیاکسید کربن، کربن مونوکسید، ترکیبات سیانیدی و کربناتها میپردازد.
شیمی معدنی، که به اکثریت عناصری که در شیمی آلی روی آنها تأکید نشده، و برخی خواص مولکولها میپردازد.
شیمی فیزیک، که پایه و اساس کلیهٔ شاخههای دیگر را تشکیل میدهد، و شامل ویژگیهای فیزیکی مواد و ابزار تئوری بررسی آنهاست.
زیستشیمی، مطالعهٔ فرایندهای شیمیایی در سازوارههای زیستی است. زیستشیمی با ساختار و عملکرد اجزاء سلولی مثل پروتئینها، کربوهیدراتها، لیپیدها، اسیدهای نوکلئیک، و انواع دیگر زیستمولکولها سر و کار دارد.
علم مواد، یک حوزهٔ میان رشتهای است که در آن رابطهٔ بین ساختار و خواص مواد به منظور طراحی مواد جدید برای پاسخگویی به نیازهای روزافزون فناوری مواد مورد بررسی قرار میگیرد. امروزه با افزایش تحقیقات در زمینهٔ نانو، مهندسی مواد به یکی از رشتههای پیشرو در عرصه دانش بدل شدهاست.
شیمی اعصاب، که به مطالعهٔ مواد شیمیایی عصبی و مطالعهٔ پیامرسانهای عصبی و نقش آنها در دستگاه عصبی بدن و تأثیرات آنها بر نورونها میپردازد.
شیمی هستهای، جزئیات ماهیت پیوندی (نیرویی) که پروتونها و نوترونها را به یکدیگر نگه میدارد و خواص هسته از قبیل رادیواکتیویته، تغییرات و تبدیلات مصنوعی، شکست هسته و ذوب هستهها را مورد بررسی قرار میدهد.
اشعه ایکس، پرتوهای آلفا و بتا و گاما و ساختارهای اتمی از جمله موارد مورد بررسی شیمی هستهای هستند.
شیمی نظری، که به توصیف پدیدههای شیمیایی با استفاده از خواص فیزیکی مواد میپردازد. این حوزه از علم در سالهای اخیر بیشتر در بخشهایی نظیر شیمی کوانتوم گسترش داشتهاست.
زمینههای دیگر عبارتند از: شیمی کشاورزی، اخترشیمی (و کیهانشیمی), شیمی جو، مهندسی شیمی، زیستشناسی شیمیایی، شیمیانفورماتیک، الکتروشیمی، شیمی محیط زیست، فمتوشیمی، زمینشیمی، شیمی سبز، ایمونوهیستوشیمی، تاریخ شیمی، هیدروژنه کردن، ایمونوشیمی، شیمی دریایی، علم مواد، شیمی ریاضیاتی، مکانوشیمیایی، شیمی دارویی، زیستشناسی مولکولی، مکانیک مولکولی، فناوری نانو، فراورده طبیعی، میشناسی، شیمی آلی فلزی، پتروشیمی، داروشناسی، فوتوشیمی، شیمی آلی فیزیکی، فیتوشیمی، شیمی بسپار، پرتوشیمی، شیمی حالت جامد، آواشیمی، شیمی فراذرهای، علم سطح، سنتز شیمیایی، ترموشیمی.
صنایع شیمیایی

یک پالایشگاه نفت در لویزیانا
صنایع شیمیایی به بخشی از صنایع گفته میشود، که مواد شیمیایی مورد نیاز دیگر صنایع را، از طریق تبدیل مواد خام به مواد مورد نیاز، تأمین میکند. پالایشگاهها و واحدهای پتروشیمی که مواد خام نفتی را به موادی چون سوخت، حلال (محصولات غذایی)، رزین و… تبدیل میکنند نمونهای از صنایع شیمیایی بهشمار میروند؛ و جز این دسته میباشند.
جوامع حرفهای
- انجمن شیمی آمریکا
- انجمن شیمی اعصاب آمریکا
- مؤسسه شیمی کانادا
- انجمن مواد شیمیایی پرو
- آیوپاک
- مؤسسه شیمی سلطنتی استرالیا
- انجمن شیمی شیمی سلطنتی هلند
- انجمن سلطنتی شیمی
- انجمن صنایع شیمیایی
- انجمن جهانی متخصصان نظری و محاسباتی
- فهرست جوامع شیمی
جستارهای وابسته
- سال جهانی شیمی
- فهرست شیمیدانها
- فهرست ترکیبات
منابع
↑ «دوم». در شیمی (۳) و آزمایشگاه. چاپ هفتم. سازمان پژوهش و برنامهریزی آموزشی. ۷۳. شابک ۹۶۴-۰۵-۱۳۵۵-۵.
↑ Eagle, Cassandra T.; Jennifer Sloan (1998). "Marie Anne Paulze Lavoisier: The Mother of Modern Chemistry". The Chemical Educator. 3 (5): 1–18. doi:10.1007/s00897980249a..mw-parser-output cite.citationfont-style:inherit.mw-parser-output qquotes:"""""""'""'".mw-parser-output code.cs1-codecolor:inherit;background:inherit;border:inherit;padding:inherit.mw-parser-output .cs1-lock-free abackground:url("//upload.wikimedia.org/wikipedia/commons/thumb/6/65/Lock-green.svg/9px-Lock-green.svg.png")no-repeat;background-position:right .1em center.mw-parser-output .cs1-lock-limited a,.mw-parser-output .cs1-lock-registration abackground:url("//upload.wikimedia.org/wikipedia/commons/thumb/d/d6/Lock-gray-alt-2.svg/9px-Lock-gray-alt-2.svg.png")no-repeat;background-position:right .1em center.mw-parser-output .cs1-lock-subscription abackground:url("//upload.wikimedia.org/wikipedia/commons/thumb/a/aa/Lock-red-alt-2.svg/9px-Lock-red-alt-2.svg.png")no-repeat;background-position:right .1em center.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registrationcolor:#555.mw-parser-output .cs1-subscription span,.mw-parser-output .cs1-registration spanborder-bottom:1px dotted;cursor:help.mw-parser-output .cs1-hidden-errordisplay:none;font-size:100%.mw-parser-output .cs1-visible-errorfont-size:100%.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registration,.mw-parser-output .cs1-formatfont-size:95%.mw-parser-output .cs1-kern-left,.mw-parser-output .cs1-kern-wl-leftpadding-left:0.2em.mw-parser-output .cs1-kern-right,.mw-parser-output .cs1-kern-wl-rightpadding-right:0.2em
↑ Chemistry 412 course notes. "A Brief History of the Development of Periodic Table". Western Oregon University. Retrieved July 20, 2015.
↑ Note: "...it is surely true that had Mendeleev never lived modern chemists would be using a Periodic Table" and "Dmitri Mendeleev". Royal Society of Chemistry. Retrieved July 18, 2015.
↑ http://www.accessscience.com/abstract.aspx?id=410600&referURL=http%3a%2f%2fwww.accessscience.com%2fcontent.aspx%3fid%3d410600 "Matter (physics)". McGraw-Hill's Access Science: Encyclopedia of Science and Technology Online. Retrieved 2009-05-24.
↑ https://books.google.co.uk/books?id=ZU1LL4IbDKcC&pg=PA21&hl=en R. Penrose (1991). "The mass of the classical vacuum". In S. Saunders, H.R. Brown. The Philosophy of Vacuum. Oxford University Press. p. 21. ISBN 0-19-824449-5.
↑ Définitions lexicographiques [archive] et étymologiques [archive] de "atome" du Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales
↑ The works of Apuleius, page 247
↑ Livingstone, page 218
↑ Iranica, Smith 2003
↑ مقاله اتم، دانشنامه بریتنیکا
↑ ویکیپدیای انگلیسی
↑ "Official SI Unit definitions". Bipm.org. Retrieved 2011-06-12.
↑ Hill, J.W.; Petrucci, R.H.; McCreary, T.W.; Perry, S.S. (2005). General Chemistry (4th ed.). Upper Saddle River, New Jersey: Pearson Prentice Hall. p. 37.
↑ M. M. Avedesian; Hugh Baker. Magnesium and Magnesium Alloys. ASM International. p. 59.
↑ American Scientist Online
↑ Peter Atkins and Julio de Paula, Physical chemistry, W. H. Freeman; 8th edition, U.S.A, 2006. ISBN 0-7167-8759-8
↑ Miessler, G.L. , Tarr, D. A.. Inorganic Chemistry. 1991. 166.
↑ Miessler, G. (1991). Inorganic Chemistry (2nd ed.). Prentice Hall. ISBN 0-13-465659-8. Chapter 6: Acid-Base and Donor-Acceptor Chemistry
↑ مورتیمر، چارلز. شیمی عمومی ۲. ج. دوم. تهران: نشر علوم دانشگاهی، ۱۳۸۳. شابک ۹۶۴۶۱۸۶۳۳۵.
↑ Concise Encyclopedia of Chemistry. New York: McGraw-Hill, 2004. ISBN 0-07-143953-6.
↑ Lewis, G.N. , Valence and the Structure of Atoms and Molecules (1923) p. 142.
- Chemistry: The Central Science by by Theodore E. Brown, H. Eugene LeMay, Bruce E. Bursten & Catherine Murphy, Publisher: Prentice Hall, 2008
- Chemistry: Concepts and Problems: A Self-Teaching Guide (Wiley Self-Teaching Guides) by Clifford C. Houk and Richard Post & Patrick Woodward, Publisher: Wiley, 1996
پیوند به بیرون
| Wikiversity has learning materials about chemistry at The School of Chemistry |
در پروژههای خواهر میتوانید در مورد Chemistry اطلاعات بیشتری بیابید.
اصول، الگوها و کاربردهای شیمی عمومی.
رده:
- شیمی
(window.RLQ=window.RLQ||[]).push(function()mw.config.set("wgPageParseReport":"limitreport":"cputime":"0.700","walltime":"0.933","ppvisitednodes":"value":5772,"limit":1000000,"ppgeneratednodes":"value":0,"limit":1500000,"postexpandincludesize":"value":103209,"limit":2097152,"templateargumentsize":"value":5564,"limit":2097152,"expansiondepth":"value":14,"limit":40,"expensivefunctioncount":"value":5,"limit":500,"unstrip-depth":"value":1,"limit":20,"unstrip-size":"value":26960,"limit":5000000,"entityaccesscount":"value":2,"limit":400,"timingprofile":["100.00% 626.336 1 -total"," 47.05% 294.664 1 الگو:پانویس"," 21.71% 135.956 4 الگو:یادکرد/هسته"," 15.85% 99.263 2 الگو:یادکرد"," 14.12% 88.441 1 الگو:Cite_journal"," 9.66% 60.535 1 الگو:دانشها"," 8.93% 55.962 1 الگو:Sidebar_with_collapsible_lists"," 8.24% 51.580 2 الگو:یادکرد_کتاب"," 7.02% 43.957 2 الگو:به_زبان_دیگر"," 6.56% 41.079 2 الگو:Lang"],"scribunto":"limitreport-timeusage":"value":"0.196","limit":"10.000","limitreport-memusage":"value":5898756,"limit":52428800,"cachereport":"origin":"mw1330","timestamp":"20190320173911","ttl":2592000,"transientcontent":false););"@context":"https://schema.org","@type":"Article","name":"u0634u06ccu0645u06cc","url":"https://fa.wikipedia.org/wiki/%D8%B4%DB%8C%D9%85%DB%8C","sameAs":"http://www.wikidata.org/entity/Q2329","mainEntity":"http://www.wikidata.org/entity/Q2329","author":"@type":"Organization","name":"Contributors to Wikimedia projects","publisher":"@type":"Organization","name":"Wikimedia Foundation, Inc.","logo":"@type":"ImageObject","url":"https://www.wikimedia.org/static/images/wmf-hor-googpub.png","datePublished":"2004-03-27T01:37:20Z","dateModified":"2019-01-24T07:14:15Z","image":"https://upload.wikimedia.org/wikipedia/commons/3/3b/Buckminsterfullerene_animated.gif"(window.RLQ=window.RLQ||[]).push(function()mw.config.set("wgBackendResponseTime":159,"wgHostname":"mw1319"););