کربن محتویات دگرشکلهای کربن خواص الکتریکی کربن (رسانا) اشکال تولید کربن کاربردها پیشینه دگرگونهها (آلوتروپها) پیدایش ترکیبات غیر آلی زنجیره کربن چرخه کربن ایزوتوپها ویژگیهای کربن منابع پیوند به بیرون منوی ناوبریو10.1016/0008-6223(76)90010-510.1016/j.carbon.2004.12.027"Fourier Transform Spectroscopy of the System of CP""Fourier Transform Spectroscopy of the Electronic Transition of the Jet-Cooled CCI Free Radical""کربن: Binary compounds"Magnetic susceptibility of the elements and inorganic compoundsProperties of diamond"Carbon nanotubes for science and technology"10.1002/bltj.201121089-7089Los Alamos National Laboratory - CarbonWebElements.com - CarbonEnvironmentalChemistry.com - CarbonIt's Elemental - CarbonCarbon Fullerene and other Allotropesووو
اکسیدهاCO2COکربونیلهای فلزیکربنیک اسیدبیکربناتهاکربناتهاسروانتیتSbOاکسید کبالت (II، III)CoOاکسید آهن (II، III)FeOتتراکسید سربPbOمنگنز (II، III) اکسیدMnOاکسید نقره (I، III)AgOاکسید آلومینیوم (II)AlOاکسید باریمBaOاکسید برلیومBeOکادمیم اکسیدCdOآهکCaOکربن مونوکسیدCOاکسید کروم (II)CrOاکسید کبالت (II)CoOمس (II) اکسیدCuOاکسید آهن (II)FeOاکسید سرب (II)PbOاکسید منیزیمMgOجیوه (II) اکسیدجیوهOاکسید نیکل (II)NiOنیتریک اکسیدNOاکسید پالادیم (II)PdOاکسید استرانسیمSrOمونواکسید گوگردSODisulfur dioxideSOاکسید قلع (II)SnOاکسید تیتانیوم (II)TiOاکسید وانادیم (II)VOاکسید رویZnOکربن دیاکسیدCOکربن تریاکسیدCOاکسید سریم (IV)CeOدیاکسید کلرClOاکسید کروم (IV)CrOدینیتروژن تترااکسیدNOژرمانیم دیاکسیدGeOاکسید هافنیم (IV)HfOدیاکسید سربPbOمنگنز دیاکسیدMnOنیتروژن دیاکسیدNOپلوتونیوم (IV) اکسیدPuOاکسید رودیم (IV)RhOاکسید روتنیوم (IV)RuOسلنیوم دیاکسیدSeOسیلیسیم دیاکسیدSiOگوگرد دیاکسیدSOدیاکسید تلوریمTeOدیاکسید توریمتوریمOدیاکسید قلعSnOتیتانیوم دی اکسیدTiOاکسید تنگستن (IV)WOاورانیوم دیاکسیدUOاکسید وانادیم (IV)VOدیاکسید زیرکونیومZrOتریاکسید کرومCrOتریاکسید مولیبدنMoOرنیوم تریاکسیدReOتریاکسید سلنیومSeOتری اکسید سولفورSOتریاکسید تلوریمTeOتنگستن تریاکسیدWOتریاکسید اورانیمUOزنون تریاکسیدXeOاسمیم تتراکسیدOsOتتراکسید روتنیمRuOزنون تتراکسیدXeOIridium tetroxideIrOHassium tetroxideHsO
کربندگرشکلهای کربنزیستشناسی و داروشناسی عنصرهای شیمیاییعناصر شیمیاییعوامل کاهندهکانیهای آلیکانیهای کربناتنافلزهاجدول تناوبی
15عنصری شیمیائیجدول تناوبیعدد اتمیغیر فلزیدگرشکلالماسگرافیتفولادعناصراکسیژندیاکسید کربنهیدروژنهیدرو کربنهافسیلیاسیدهای چربایزوتوپC-۱۴تاریخگذاری رادیوکربنهمسانگردابر رسانافلورنهانانولولههای کربنیپیونداتمهایزمینکربن – نیتروژنخورشیدستارگانمهبانگذرات آلفاهلیمنمودار H-Rهلیمفرایند سهگانه آلفابرتر پنداری کربنسوختهای فسیلیگاز متاننفت خامصنعت پتروشیمیبنزینگازوئیلنفت سفیدتقطیرپالایشگاههاپلاستیکمیله کنترلواکنشگاههای اتمیفولرنریزتیوب کربنلاتینپیشاتاریخزغال چوبشکلغیر متبلورگرافیتالماسفولرنگرافیتزغال چوبدودهگرافیتشش وجهیهیدروکربنهای معطربتاابر piالکتریسیتهنیروهای وان در والسالماسسیلسیمژرمانیمنیترید بورهمالکترونسایشگرافیتلونسدالیتدانشخورشیدستارگاندنباله دارهاجوسیاراتشهابسنگهامنظومه شمسیدیسک گازی شکلکلسیممنیزیمآهنسنگکربناتسنگ آهکدولمیتسنگ مرمرهیدروژنزغال سنگنفت خامگاز طبیعینیویورکتکزاسآمریکاروسیهمکزیکگرینلندهندکیمبرلیتآذرینآفریقاآفریقای جنوبینامیبیابوتسواناجمهوری کنگوسیرالئونکاناداروسیهبرزیلاسترالیاشیمی آلیدیاکسید کربناتمسفرآباسید کربنیکیونهایکربناتکلسیتدی سولفید کربنمونوکسید کربنقطبیهموگلوبینهالیدسیانوژنفلزاتمتاناستیلنپائتیکاسیدپیوندهای کووالانسیکربوراندومالماسفروگشتفراگشتدگرگشتمتابولیسمچرخه کربناتحادیه بینالمللی شیمی کاربردی و محضایزوتوپکربن- ۱۲اوزان اتمیکربن- ۱۴رادیوایزوتوپینیمه عمرتاریخ یابی رادیو کربنباستانشناسیایزوتوپ پایدارdفتوسنتزبافتجوگیاهان مسیر C۳گیاهان مسیر C۴گیاهان کممواد مغذیمونوکسید کربنپستاندارانگازهایاتیلناتانکوالانسی
کربن
پرش به ناوبری
پرش به جستجو
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظاهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
سیاه (گرافیت) و بیرنگ (الماس) طیف نشری خطی کربن | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای کلی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
نام، نماد، عدد | کربن، C، 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تلفظ به انگلیسی | /ˈkɑːrbən/ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نام گروهی برای عناصر مشابه | نافلزات | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
گروه، دوره، بلوک | ۱۴، ۲، p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
جرم اتمی استاندارد | 12.0107(8) گرم بر مول | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
آرایش الکترونی | 1s2 2s2 2p2 or [He] 2s2 2p2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
الکترون به لایه | 2,4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای فیزیکی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
حالت | جامد | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
چگالی (نزدیک به دمای اتاق) | amorphous:[۱] 1.8–2.1 g·cm−۳ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
چگالی (نزدیک به دمای اتاق) | graphite: 2.267 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
چگالی (نزدیک به دمای اتاق) | diamond: 3.515 g·cm−۳ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
نقطه سهگانه | 4600 K (4327°C) ، 10800[۲][۳] kPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
گرمای همجوشی | 117 (graphite) کیلوژول بر مول | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ظرفیت گرمایی | 8.517(graphite), 6.155(diamond) کیلوژول بر مول | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای اتمی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
وضعیت اکسید شدن | 4, 3,[۴] 2, 1,[۵]0, -1, -2, -3, -4[۶] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
الکترونگاتیوی | 2.55 (مقیاس پاولینگ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
انرژیهای یونش (more) | نخستین: 1086.5 کیلوژول بر مول | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دومین: 2352.6 کیلوژول بر مول | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سومین: 4620.5 کیلوژول بر مول | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
شعاع کووالانسی | 77(sp³), 73(sp²), 69(sp) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
شعاع واندروالانسی | 170 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| متفرقه | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
مغناطیس | دیامغناطیس[۷] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
مقاومت ویژه الکتریکی | (20 °C) 7.837 µΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
رسانایی گرمایی | (300 K) 119-165 (graphite) 900-2300 (diamond) W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
انبساط گرمایی | (25 °C) 0.8 (diamond)[۸] µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
سرعت صوت (سیم نازک) | (20 °C) 18350 (diamond) m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
مدول یانگ | 1050 (diamond)[۸] GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
مدول برشی | 478 (diamond)[۸] GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
مدول حجمی | 442 (diamond)[۸] GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
نسبت پواسون | 0.1 (diamond)[۸] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
سختی موس | 1-2 (Graphite) 10 (Diamond) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
عدد کاس | 7440-44-0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| پایدارترین ایزوتوپها | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مقاله اصلی ایزوتوپهای کربن | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
کربن عنصری شیمیائی در جدول تناوبی با نشان C و عدد اتمی ۶ است. عنصری غیر فلزی و فراوان، چهارظرفیتی و دارای چندین دگرشکل است. چنین کربنی همسانگرد و مانند شیشه محکم است. لایههای گرافیت آن مانند کتاب مرتب نشدهاند، بلکه مانند کاغذ خرد شده میباشند. نوع خالص و متراکم آن الماس و نوع نرم و غیر متراکم آن گرافیت است.
الیاف کربن شبیه کربن شیشهای هستند. تحت مراقبتهای ویژهای؛ (کشیدن الیاف آلی و کربنی کردن)، میتوان لایههای صاف کربن را در جهت الیاف مرتب کرد. هیچ لایهٔ کربنی در جهت عمود بر محور الیاف قرار نمیگیرد. نتیجه الیافی با استحکام بیشتر از فولاد است.
کربن در ساختار بدنی تمامی جانداران وجود داشته و پایه ی [شیمی آلی] را تشکیل میدهد. همچنین این غیر فلز ویژگی جالبی دارد که میتواند با خودش و انواع زیادی از عناصر دیگر پیوند برقرار کند؛ (تشکیل دهندهٔ بیش از ده میلیون ترکیب). در صورت ترکیب با اکسیژن تولید دیاکسید کربن میکند که برای رویش گیاهان، حیاتی است. در صورت ترکیب با هیدروژن ترکیبات مختلفی بنام هیدرو کربنها را بوجود میآورد که به شکل سوختهای فسیلی، در صنعت بسیار بنیادی هستند. وقتی هم با اکسیژن و هم با هیدروژن ترکیب گردد، گروه زیادی از ترکیبات را از جمله اسیدهای چرب را میسازد که برای حیات و استر، که طعم دهنده بسیاری از میوهها است، ضروری است. ایزوتوپ C-۱۴ بهطور متداول در تاریخگذاری رادیوکربن کاربرد دارد.
محتویات
۱ دگرشکلهای کربن
۲ خواص الکتریکی کربن (رسانا)
۳ اشکال
۴ تولید کربن
۵ کاربردها
۵.۱ دیگر کاربردها
۶ پیشینه
۷ دگرگونهها (آلوتروپها)
۸ پیدایش
۹ ترکیبات غیر آلی
۱۰ زنجیره کربن
۱۱ چرخه کربن
۱۲ ایزوتوپها
۱۲.۱ هشدارها
۱۳ ویژگیهای کربن
۱۴ منابع
۱۵ پیوند به بیرون
دگرشکلهای کربن
الماس، سختترین کانی شناختهشده و دارای بالاترین سرعت صوت و رسانایی گرمایی در میان مواد
گرافیت، یکی از نرمترین مواد است که در نوک مداد از ان استفاده شدهاست.
فولرن، مولکولهایی در حد بیلیونیوم متر هستند و اشکال مختلفی دارند.
دوده چراغ از سطوح کوچک گرافیت تشکیل شده. این سطوح به صورت تصادفی توزیع شده، به همین دلیل کل ساختمان آن همسانگرد (ایزوتروپ) است.
خواص الکتریکی کربن (رسانا)
کربن به عنوان یک ماده الکتریکی شناخته میشود. کربن میتواند به شکلهای مختلفی باشد: یک رسانای خوب به شکل گرافیت، یکنیمهرسانای خیلی سخت با فاصله زیاد به شکل الماس، یک ابر رسانا هنگامی که با یک جزء مناسب مخلوط شود. به علاوه؛ مواد الکتریکی بر پایه کربن نمونههایی از مواد را عرضه میکنند که مجموعهٔ به هم پیوستهای از ابعاد را نشان میدهند از فلورنها که نقاط ذرهای صفر بعدی هستند، تا نانولولههای کربنی که لولههای کوانتومی ۱ بعدی هستند، تا گرافیت که ماده غیر همسان لایهای ۲ بعدی است و سرانجام تا الماس، یک نیمهرسانا با فاصلهٔ عریض ۳ بعدی.[۹]
اشکال
کربن به دلایل زیادی قابل توجهاست. اشکال مختلف آن شامل یکی از نرمترین (گرافیت) و یکی از سختترین (الماس) مواد شناخته شده توسط انسان است. افزون بر این، کربن میل زیادی به پیوند با اتمهای کوچک دیگر از جمله اتمهای دیگر کربن، داشته و اندازهٔ بسیار کوچک آن امکان پیوندهای متعدد را بوجود میآورد. این خصوصیات باعث شکلگیری ده میلیون ترکیبات کربنی شدهاست. ترکیبات کربن زیر بنای حیات را در زمین میسازند و چرخهٔ کربن – نیتروژن قسمتی از انرژی تولید شده توسط خورشید و ستارگان دیگر را تأمین میکند.
تولید کربن
کربن در اثر مهبانگ (انفجار بزرگ آغازین) حاصل نشده، چون این عنصر برای تولید نیاز به یک برخورد سه مرحلهای ذرات آلفا (هسته اتم هلیم) دارد. جهان در ابتدا گسترش یافت و چنان به سرعت سرد شد که امکان تولید آن غیرممکن بود. به هر حال، کربن درون ستارگانی که در رده افقی نمودار H-R قرار دارند، یعنی جائی که ستارگان هسته هلیم را با فرایند سهگانه آلفا به کربن تبدیل میکنند، تولید شد.
کاربردها
کربن بخش بسیار مهمی در تمامی موجودات زندهاست و تا آنجا که میدانیم بدون این عنصر زندگی وجود نخواهد داشت (به برتر پنداری کربن مراجعه کنید). عمدهترین کاربرد اقتصادی کربن، فرم هیدروکربنها میباشد که قابل توجهترین آنها سوختهای فسیلی، گاز متان و نفت خام است. نفت خام در صنعت پتروشیمی برای تولید محصولات زیادی از جمله مهمترین آنها بنزین، گازوئیل و نفت سفید بکار میرود که از طریق فرایند تقطیر در پالایشگاهها بدست میآیند. از نفت خام مواد اولیه بسیاری از مواد مصنوعی، که بسیاری از آنها در مجموع پلاستیک نامیده میشوند، شکل میگیرد.
دیگر کاربردها
ایزوتوپ C-۱۴ که در ۲۷ فوریه ۱۹۳۰ کشف شد در سن یابی کربن پرتوزا مورد استفادهاست.- گرافیت در ترکیب با خاک رس بهعنوان مغز مداد بکار میرود.
- الماس جهت تزئین ونیز در متهها و سایر کاربردهایی که سختی آن مورد استفادهاست کاربرد د ارد.
- برای تولید فولاد، به آهن کربن اضافه میکنند.
کربن در میله کنترل در واکنشگاههای اتمی بکار میرود.
- گرافیت به شکل پودر و سفت شده بهعنوان زغال چوب برای پخت غذا، در آثار هنری و موارد دیگر مورد استفاده قرار میگیرد.
- قرصهای زغال چوب در پزشکی که به صورت قرص یا پودر وجود دارند برای جذب سم از دستگاه گوارشی مورد استفادهاند.
خصوصیات ساختمانی و شیمیایی فولرن به شکل ریزتیوب کربن، کاربردهای بالقوه امیدوارکنندهای در رشته در حال شکلگیری نانوتکنولوژی دارد.
پیشینه
کربن (واژه لاتین carbo به معنی زغال چوب) در دوران پیشاتاریخ کشف شد و برای مردم باستان که آن را از سوختن مواد آلی در اکسیژن ضعیف تولید میکردند، آشنا بود. (تولید زغال چوب). مدت طولانی است که الماس بهعنوان مادهای زیبا و کمیاب به حساب میآید. فولرن، آخرین آلوتروپ شناخته شده کربن در دهه ۸۰ بهعنوان محصولات جانبی آزمایشهای پرتو مولکولی کشف شدند.
دگرگونهها (آلوتروپها)
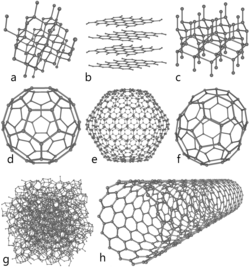
هشت آلوتروپ از کربن

نمودار فازی کربن
تاکنون چهار شکل گوناگون از کربن شناخته شدهاست: غیر متبلور، گرافیت، الماس و فولرن.
کربن در نوع غیر بلورین آن اساساً گرافیت است اما به صورت ساختارهای بزرگ بلورین وجود ندارد. این شکل کربن، بیشتر به صورت پودر است که بخش اصلی موادی مثل زغال چوب و سیاهی چراغ (دوده) را تشکیل میدهد.
در فشار و دمای اتاق کربن به شکل گرافیت پایدارتر است که در آن هر اتم با سه اتم دیگر به صورت حلقههای شش وجهی- درست مثل هیدروکربنهای معطر - به هم متصل شدهاند. هردو گونه شناخته شده از گرافیت، آلفا (شش ضلعی) و بتا (منشور شش وجهی که سطوح آن لوزی است) خصوصیات فیزیکی همانند دارند تنها تفاوت آنها در ساختار بلوری آنها است. گرافیتهای طبیعی شامل بیش از ۳۰٪ نوع بتا هستند در حالیکه گرافیتهای مصنوعی تنها حاوی نوع آلفا میباشند. نوع آلفا از طریق فرآوری مکانیکی میتواند به بتا تبدیل شود و نوع بتا نیز بر اثر دمای بالای ۱۰۰۰ درجه سانتیگراد دوباره به صورت آلفا بر میگردد.
گرافیت به سبب پراکندگی ابر pi هادی الکتریسیته است. این ماده نرم بوده و ورقههای آن که اغلب بهوسیله اتمهای دیگر تفکیک شدهاند، تنها بهوسیلهٔ نیروهای وان در والس به هم چسبیدهاند به گونهای که به راحتی یکدیگر را کنار میزنند.
در دما و فشارهای خیلی بالا کربن به صورت الماس پایدار است که در آن هر اتم با چهار اتم دیگر پیوند دارد. الماس ساختار مکعبی همانند سیلسیم و ژرمانیم دارد و (به سبب نیروی پیوندهای کربن – کربن) با نیترید بور همالکترون(BN) در کنارهم بوده و سختترین جسم از نظر مقاومت در برابر سایش بهشمار میرود. تبدیل الماس به گرافیت در حرارت اتاق به قدری کند است که محسوس نیست. در برخی شرایط کربن به شکل لونسدالیت (lonsdalite) متبلور میشود که مشابه الماس ولی شش ضلعی است.
فولرین ساختاری مثل گرافیت دارد اما به جای بخشهای تماماً شش ضلعی، حاوی پنج ضلعیها (یا احتمالاً هفت ضلعیهای) اتمهای کربن نیز میباشند که ورقه را به شکل کره، بیضی یا استوانه بوجود میآورند. ویژگیهایی از فولرین با نام فولرین باکمینستر (buckminsterfullerene) هم نامیده میشوند هنوز بخوبی بررسی نشدهاند. اینگونه ساختار را به گونهٔ کوتاه شده، گلولههای باکی (buckyballs) هم نامیدهاند. کل نامگان فولرین برگرفته از نام باکمینستر فولر (Buckminster Fuller)، توسعه دهنده گنبد میلهای است که از ساختار گلولههای باکی تقلید کرد.
پیدایش
تقریباً ده میلیون ترکیبات کربنی که برای دانش شناخته شدهاند وجود دارد که هزاران نوع آنها در فرایندهای حیاتی و واکنشهای آلی بسیار مهم اقتصادی، ضروری هستند. این عنصر به مقدار فراوان در خورشید، ستارگان، دنباله دارها و نیز در جو بیشتر سیارات یافت میشود. بعضی از شهابسنگها حاوی الماسهای میکروسکپی هستند که در زمانیکه منظومه شمسی هنوز یک دیسک گازی شکل بود شکل گرفتهاند. کربن به صورت ترکیب با سایر عناصر در جو زمین وجود دارد و در همه گونه آب حل میشود. کربن به همراه مقادیر کمتر کلسیم، منیزیم و آهن، عنصر اصلی سازنده جرم زیادی از سنگ کربنات (سنگ آهک، دولمیت، سنگ مرمر و…) است. این عنصر در صورت ترکیب با هیدروژن تولید زغال سنگ، نفت خام و گاز طبیعی میکند که آنها را هیدرو کربن مینامند.
گرافیت به مقدار فراوان در نیویورک و تکزاس، آمریکا، روسیه، مکزیک، گرینلند و هند یافت میشود.
الماس طبیعی در کیمبرلیت معدنی موجود درچینهها یا ستونهای سنگهای آذرین یافت میشوند. بیشترین الماس در آفریقا به ویژه آفریقای جنوبی، نامیبیا، بوتسوانا، جمهوری کنگو و سیرالئون وجود دارد. همچنین کانادا، قسمتهای قطبی روسیه، برزیل و بخشهای غربی و شرقی استرالیا دارای الماس میباشد.
ترکیبات غیر آلی
(به شیمی آلی هم مراجعه کنید)
معروفترین اکسید کربن، دیاکسید کربن (CO2) است که به مقدار کمتری در اتمسفر زمین وجود دارد. این اکسید توسط موجودات زنده، و برخی موارد دیگر تولید شده و مورد استفاده قرار میگیرد. آب مقدار کمی اسید کربنیک تولید میکند اما دیاکسید کربن مانند بیشتر ترکیباتی که دارای پیوندهای ساده چندگانه با اکسیژنهای روی یک کربن هستند، ناپایدار است. به هر حال، از طریق این واسطه، یونهای کربنات با تشدید تثبیت شده، بوجود میآیند. تعدادی از مواد معدنی مهم، کربناتها هستند که معروفترین آنها کلسیت است. دی سولفید کربن، (۲ CS)، هم مانند آن است.
اکسیدهای دیگر آن، مونوکسید کربن (CO) و زیراکسید (suboxide) نادر C3O۲ هستند. مونوکسید کربن که گازی بیرنگ و بیبو است بهوسیله اکسیده شدن ناقص بوجود میآید. هر یک از این مولکولها دارای یک پیوند سهگانه و نسبتاً قطبی هستند که ناشی از تمایل به یک پیوند دائمی با مولکولهای هموگلوبین میباشد بهطوریکه این گاز بسیار سمی است. سیانید (CN-) دارای ساختار و رفتاری بسیار شبیه به یون هالید بوده و نیترید سیانوژن (CN2) نیز به آن مربوط است.
کربن با فلزات قوی، کاربید C-، یا استیلید C22-؛ بوجود میآورد که با متان و استیلن همراه بوده و هر دوی آنها اسیدهای بهطور باور نکردنی پائتیک اسید هستند. در کل، کربن با الکترو نگاتیوی ۵/۲ به تشکیل پیوندهای کووالانسی تمایل دارد. تعداد کمی از کاربیدها مثل کربوراندوم و Sic، که شبیه الماس میباشند، به صورت شبکههای کووالانسی هستند.
زنجیره کربن
در ساختار اتمی هیدروکربنها، گروهی از اتمهای کربن (اشباع شده با اتمهای هیدروژن) تشکیل یک زنجیره میدهند. روغنهای فرار زنجیرههای کوچکتری دارند. چربیها دارای زنجیرههای بلندتر و پارافینها زنجیرههایی بیاندازه بلند دارند.
چرخه کربن
فرایند مداوم ترکیب و آزادسازی کربن و اکسیژن که در آن انرژی و حرارت ذخیره و دفع میشود را چرخه کربن میگویند. فروگشت (کاتابولیسم) + فراگشت (آنابولیسم) = دگرگشت (متابولیسم). (واژهها از فرهنگستان زبان و ادب فارسی). به چرخه کربن مراجعه کنید
ایزوتوپها
اتحادیه بینالمللی شیمی کاربردی و محض در سال ۱۹۶۱ ایزوتوپ کربن- ۱۲ را برای اوزان اتمی اتخاذ کرد. کربن- ۱۴ رادیوایزوتوپی است با نیمه عمر ۵۷۱۵ سال و برای تاریخ یابی رادیو کربن چوب، نقاط باستانشناسی و نمونهها کاربرد بسیار زیادی دارد.
کربن دارای دو ایزوتوپ پایدار طبیعی میباشد: (C-۱۲(۹۸٫۸۹٪ و C-۱۳(۱٫۱۱٪). نسبت این ایزوتوپها در؟ به نسبت الگوی VPDB (Vienna Pee Dee Belemnite from the Peedee Formation of South Carolina).
d C-۱۳ در اتمسفر ۷ -؟ است است. هنگام فتوسنتز، کربنی که در بافت گیاه تثبیت میشود، بهطور قابل ملاحظهای به C-۱۳ موجود در جو بستگی دارد.
دو حالت برای توزیع مقادیر dC-۱۳ در گیاهان خشکی وجود دارد که ناشی از تفاوتهایی است که گیاهان در واکنشهای فتوسنتز بکار میبرند. بیشتر گیاهان خشکی، گیاهان مسیر C۳ هستند و دارای ارزشهای dC-۱۳ بوده که بین ۲۴- و ۳۴- قرار دارند(؟). دومین گروه از گیاهان (گیاهان مسیر C۴) میباشند که ترکیبی از گیاهان آبی، صحرایی، شوراب زار و مرغزارهای استوایی هستند، و دارای ارزشهای dC-۱۳ بین ۶- و ۱۹- میباشند. یک گروه واسطه (گیاهان کم)، متشکل از جلبک و گلسنگ، دارای ارزشهای dC-۱۳ میباشد که بین ۱۲- و ۲۳-؟ هستند. dC-۱۳ گیاهان و موجودات زنده دادههای سودمندی دربارهٔ مواد مغذی و ارتباطات شبکه غذایی ارائه میکند.
هشدارها
ترکیبات کربن گستره وسیعی از آثار سمی دارند. مونوکسید کربن (C O) موجود در اگزوز موتورهای درونسوز و سیانید (CN) که گاهی اوقات در آلودگیهای معدنی وجود دارد برای پستانداران بسیار سمی هستند. بسیاری از ترکیبات دیگر کربن نه تنها سمی نیستند بلکه در واقع برای زیست ضروری میباشند. گازهای آلی مثل اتیلن (H2C=CH2) و اتان و (HCCH)، و متان (CH4) در صورت مخلوط شدن با هوا قابلیت انفجار و اشتعال خطرناکی پیدا میکنند.
ویژگیهای کربن
۱_کربن به دلیل ۴ ظرفیت که دارد میتواند چهار پیوند کوالانسی دهد.
۲_کربن میتواند با تمام عناصر پیوند دهد
۳_میتواند هم پیوند یگانه هم دوگانه هم سهگانه دهد
- کربن میتواند تشکیل زنجیر کربنی دهد
- کربن میتواند تشکیل انواع حلقهها (سه ضلعی تا چند ضلعی) دهد
منابع
↑ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5..mw-parser-output cite.citationfont-style:inherit.mw-parser-output qquotes:"""""""'""'".mw-parser-output code.cs1-codecolor:inherit;background:inherit;border:inherit;padding:inherit.mw-parser-output .cs1-lock-free abackground:url("//upload.wikimedia.org/wikipedia/commons/thumb/6/65/Lock-green.svg/9px-Lock-green.svg.png")no-repeat;background-position:right .1em center.mw-parser-output .cs1-lock-limited a,.mw-parser-output .cs1-lock-registration abackground:url("//upload.wikimedia.org/wikipedia/commons/thumb/d/d6/Lock-gray-alt-2.svg/9px-Lock-gray-alt-2.svg.png")no-repeat;background-position:right .1em center.mw-parser-output .cs1-lock-subscription abackground:url("//upload.wikimedia.org/wikipedia/commons/thumb/a/aa/Lock-red-alt-2.svg/9px-Lock-red-alt-2.svg.png")no-repeat;background-position:right .1em center.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registrationcolor:#555.mw-parser-output .cs1-subscription span,.mw-parser-output .cs1-registration spanborder-bottom:1px dotted;cursor:help.mw-parser-output .cs1-hidden-errordisplay:none;font-size:100%.mw-parser-output .cs1-visible-errorfont-size:100%.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registration,.mw-parser-output .cs1-formatfont-size:95%.mw-parser-output .cs1-kern-left,.mw-parser-output .cs1-kern-wl-leftpadding-left:0.2em.mw-parser-output .cs1-kern-right,.mw-parser-output .cs1-kern-wl-rightpadding-right:0.2em
↑ Haaland, D (1976). "Graphite-liquid-vapor triple point pressure and the density of liquid carbon". کربن. 14: 357. doi:10.1016/0008-6223(76)90010-5.
↑ Savvatimskiy, A (2005). "Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)". کربن. 43: 1115. doi:10.1016/j.carbon.2004.12.027.
↑ "Fourier Transform Spectroscopy of the System of CP" Check|url=value (کمک) (PDF). Retrieved 2007-12-06.
↑ "Fourier Transform Spectroscopy of the Electronic Transition of the Jet-Cooled CCI Free Radical" Check|url=value (کمک) (PDF). Retrieved 2007-12-06.
↑ "کربن: Binary compounds". Retrieved 2007-12-06.
↑ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
↑ ۸٫۰۸٫۱۸٫۲۸٫۳۸٫۴ Properties of diamond, Ioffe Institute Database
↑ Ramirez, Arthur P. (2005-11-17). "Carbon nanotubes for science and technology". Bell Labs Technical Journal (به انگلیسی). 10 (3): 171–185. doi:10.1002/bltj.20112. ISSN 1089-7089.
- Los Alamos National Laboratory - Carbon
پیوند به بیرون
- WebElements.com - Carbon
- EnvironmentalChemistry.com - Carbon
- It's Elemental - Carbon
Carbon Fullerene and other Allotropes models by Vincent Herr
جدول تناوبی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
H | | He | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Li | Be | | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Na | Mg | | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
K | Ca | | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Rb | Sr | | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||||||||||||||||||||||||||||||||||
Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ردهها:
- کربن
- دگرشکلهای کربن
- زیستشناسی و داروشناسی عنصرهای شیمیایی
- عناصر شیمیایی
- عوامل کاهنده
- کانیهای آلی
- کانیهای کربنات
- نافلزها
- جدول تناوبی
(window.RLQ=window.RLQ||[]).push(function()mw.config.set("wgPageParseReport":"limitreport":"cputime":"0.596","walltime":"0.735","ppvisitednodes":"value":7194,"limit":1000000,"ppgeneratednodes":"value":0,"limit":1500000,"postexpandincludesize":"value":215755,"limit":2097152,"templateargumentsize":"value":11361,"limit":2097152,"expansiondepth":"value":10,"limit":40,"expensivefunctioncount":"value":4,"limit":500,"unstrip-depth":"value":1,"limit":20,"unstrip-size":"value":20007,"limit":5000000,"entityaccesscount":"value":2,"limit":400,"timingprofile":["100.00% 366.099 1 -total"," 46.25% 169.313 1 الگو:جعبه_اطلاعات_کربن"," 44.99% 164.707 1 الگو:Elementbox"," 37.78% 138.314 1 الگو:پانویس"," 16.11% 58.993 1 الگو:RubberBible86th"," 15.57% 57.016 1 الگو:Cite_book"," 13.75% 50.321 1 الگو:NavPeriodicTable"," 12.93% 47.348 1 الگو:IPAc-en"," 12.70% 46.497 3 الگو:Cite_journal"," 9.68% 35.431 118 الگو:NavPeriodicTable/Elementcell"],"scribunto":"limitreport-timeusage":"value":"0.120","limit":"10.000","limitreport-memusage":"value":3974433,"limit":52428800,"cachereport":"origin":"mw1326","timestamp":"20190318045219","ttl":2592000,"transientcontent":false);mw.config.set("wgBackendResponseTime":131,"wgHostname":"mw1262"););